Amadeo Avogadro
1993/02/01 Azkune Mendia, Iñaki - Elhuyar Fundazioa Iturria: Elhuyar aldizkaria
Physicien italien né à Turin, Piémont, le 9 juin 1776.
Il a étudié le droit et en 1800, il a commencé à étudier les mathématiques et la physique. Comme il a travaillé en profondeur les sciences, exerçant l'enseignement. En 1809, il a été nommé professeur de mathématiques et de physique au collège royal de Vercelli et de 1820 professeur de physique supérieure à l'Université de Turin.
Selon la découverte de Gay-Lussac, à mesure que la température augmentait, tous les gaz étaient répartis dans la même proportion, et Avogadro, l'étudiant, eut une idée. Il considère que tous les gaz devaient avoir le même nombre de particules par unité de volume à une température donnée. Cette idée fut transférée en 1811 et commenta avec beaucoup de soin que les particules mentionnées n'avaient pas en quoi consistaient les atomes individuels. Il y avait aussi des combinaisons atomiques (que nous appelons aujourd'hui molécules).
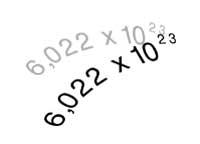
De là, il a expliqué facilement la loi de combinaison de volumes de Gay-Lussac. XIX. Au début du siècle Ritter a électrolysé l'eau en recueillant l'oxygène et l'hydrogène séparés. Il a pu vérifier que le volume d'oxygène était la moitié de celui de l'hydrogène. Avogadro a alors démontré que, en appliquant son hypothèse, la molécule d'eau avait deux atomes d'hydrogène et un atome d'oxygène. Si le poids total de l'oxygène recueilli était huit fois supérieur à celui de l'hydrogène, l'atome d'oxygène était seize fois plus lourd (et non, selon Dalton, huit fois plus lourd).
Cependant, les idées d'Avogadro n'ont pas été prises en considération dans les prochaines décennies. Dalton les abandonna et le chimiste le plus célèbre de l'époque, Berzelius, atteignit le cancer. En conséquence, les produits chimiques ont eu de grands mélanges, des atomes inséparables, des molécules, des poids atomiques et des poids moléculaires.
Stanislas Cannizzaro a été le premier à prendre en compte Avogadro, deux ans après sa mort, et c'est alors qu'il a atteint la réputation que la science touristique lui a nié dans sa vie.
Il est actuellement connu sous le nom d'Avogadro, parce que le nombre qui porte son nom sert à calculer combien d'atomes (ou molécules) ont le poids atomique exprimé en grammes. L'oxyde de carbone (IV), par exemple, a un poids moléculaire 44 et dans 44 grammes de ce gaz il y aura autant de molécules que le nombre d'Avogadro, c'est-à-dire 6,022x1023 molécules (602.600 molécules de trilion).
Il est également utilisé en chimie pour définir le mol. Un mol de substance est la quantité qui contient 6,022x1023 unités de cette substance.
Avogadro Quaregna et Comte de Ceretto décéda à Turin le 9 juillet 1856.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia






