Biocatalizadores para una industria más sostenible
2018/06/11 Lide Arana Urbieta - Biokimika eta Biologia Molekularra saileko irakasleaEHU Iturria: Elhuyar aldizkaria

De hecho, necesitaríamos años para conseguir procesos que se producen cada segundo en nuestras células. Es maravilloso cómo cambia la velocidad de cualquier reacción cuando ocurre en nuestro cuerpo. Por ejemplo, una reacción continua de los glóbulos rojos para transportar CO2 en nuestra sangre, la deshidratación del bicarbonato (Figura 1), se produce millones de veces más lentamente en el medio [1].
¿Cuál es nuestro secreto? ¿Cómo conseguimos esa velocidad? Los seres vivos formamos moléculas encargadas de acelerar o catalizar las reacciones, llamadas biocatalizadores o enzimas. Aunque no son sinónimos, la mayoría de los biocatalizadores son enzimas, es decir, proteínas con actividad catalítica.
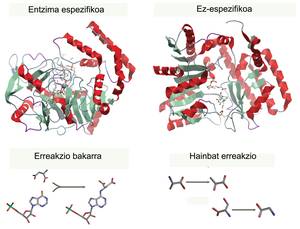
Para cada proceso hay una enzima específica que cataliza una y una sola reacción (para utilizar un único tipo de reactivo y crear un único producto), por lo que una enzima no puede producir dos productos. Son los catalizadores más eficientes y poderosos conocidos (mucho más potentes que cualquier catalizador inorgánico) y, aunque los utilizamos desde tiempos remotos, el desarrollo experimentado en los últimos años ha hecho que hoy en día sean moléculas con muchas aplicaciones. Las utilizamos para mejorar la producción industrial de diferentes productos de la vida diaria.
A nuestro alrededor se encuentran muchos ejemplos de uso industrial de las enzimas, que han entrado casi inconscientemente en el mercado. Algunos se utilizan para el tratamiento industrial de la comida, como la producción de leche sin lactosa. Otro uso conocido son las mediciones utilizadas en los controles de calidad, la mayoría de las cuales se basan en la actividad de alguna enzima. Además, en la industria farmacéutica, las enzimas pueden utilizarse para obtener una producción más específica de fármacos. Las enzimas utilizan un único sustrato para formar un único producto, por lo que se evitan las mezclas moleculares (estereoespecíficas) que se generan en una síntesis química, evitando en algunos casos productos secundarios peligrosos. Sin embargo, el ámbito de aplicación más amplio se centra en la mejora de la sostenibilidad de los procesos industriales para la generación más ecológica de productos químicos (mediante procesos no contaminantes en condiciones biológicas). Además, se producen numerosas enzimas que pueden ayudar a mejorar los procesos de lavado (detergentes para lejía en aguas frías) o mitigar la contaminación ambiental.
Sin embargo, en la naturaleza no siempre se encuentran enzimas que catalizan procesos de nuestro interés. Como se ha dicho, cada enzima conoce un único tipo de sustrato, proporcionando un producto único y específico, y diversas reacciones de interés industrial no se dan en los seres vivos. Por tanto, hemos empezado a crear nuevas enzimas o a mejorar las que teníamos, aprovechando el conocimiento de las enzimas y las tecnologías disponibles. Hasta ahora, la vía más común ha sido la de optimizar las enzimas que ya conocíamos. Al igual que se hace para la mejora de frutales o plantas, se producen mutaciones en las proteínas y se seleccionan las enzimas de características preferidas. Esta metodología se denomina evolución corregida. En ocasiones, las mutaciones se realizan específicamente en determinados puntos, en cuyo caso se dice que se ha utilizado un diseño racional. Sin embargo, el diseño de nuevas enzimas desde el vacío se está convirtiendo cada vez más en una metodología que teóricamente extendería enormemente las posibilidades de obtener nuevos biocatalizadores [2].
Tal y como es imprescindible comprender el proceso de diseño de una máquina, para poder sintetizar un biocatalizador adecuado es necesario comprender plenamente su funcionamiento y estructura. ¿Y qué es exactamente lo que sabemos sobre estas moléculas?
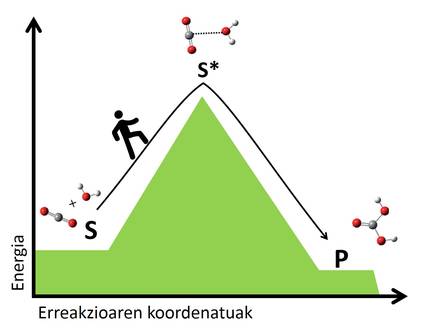
Según la teoría del estado de transición, en todas las reacciones se reordenan los átomos de los reactivos, rompiendo los enlaces y formando nuevas moléculas. En esta reorganización se crean estados de transición en los que se forman las formaciones atómicas intermedias de reactivos y productos. Las moléculas en transición son, en general, inestables y requieren mucha energía para llegar a un estado de transición desde los reactivos. Cuanto mayor sea el salto energético para llegar al estado de transición, más lento será la reacción. Es como pasar de un valle a otro, cuanto más alto sea el paso, más largo será el viaje (figura 2).
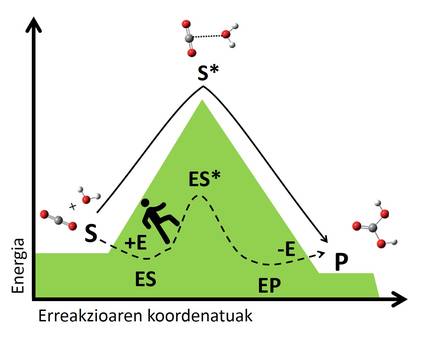
El mecanismo de los biocatalizadores se basa en la estabilización de estas situaciones de transición mediante interacciones con el sustrato. La enzima se une al sustrato formando un complejo que crea una nueva vía de reacción inexistente (Figura 3). La complejidad es más estable que el sistema formado por la enzima y el sustrato libre, y esta estabilidad reduce el salto energético necesario para llegar al estado de transición, dando lugar a una vía de reacción más rápida. Siguiendo el ejemplo anterior, podríamos entender como encontrar un sendero que nos cruza de un valle a otro, ya que es un camino que nos exige menos energía que subir y bajar a la cima, por lo que llegaremos más rápido al otro lado.
Así, si quisiéramos diseñar una enzima para catalizar una reacción, necesitaríamos una estructura compatible con el estado de transición de la reacción: algo capaz de completar interacciones estabilizadoras de la molécula, que sirviera para estabilizar el complejo y acelerar la reacción. Para que esto ocurra correctamente, además de seleccionar los átomos apropiados para completar las interacciones con el sustrato (con sus características químicas específicas), los átomos deben estar situados en el espacio en una posición y ángulo determinados, formando una red específica tridimensional [3].
En general, la zona de catálisis (zona catalítica) es muy pequeña en comparación con el volumen total de la molécula. A modo de ejemplo, podemos analizar la enzima que cataliza la hidratación de CO2, la anhidrasa carbónica (Figura 4). Como se puede observar, la zona de interacción con el sustrato es muy pequeña si se tiene en cuenta el volumen de toda la enzima.
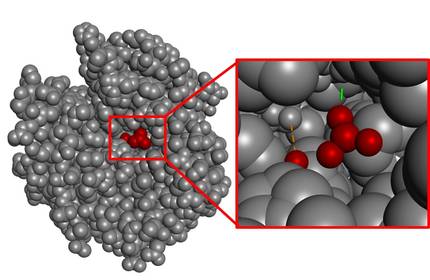
Se sabe que la naturaleza nunca malgasta energía. En consecuencia, el resto de la estructura que no es el espacio catalítico no debería entenderse como un excedente, sino como un indicador de la complejidad que supone la consecución del espacio catalán perfecto. De hecho, los posibles cambios en el átomo más alejado de esta estructura también podrían destruir la zona catalítica. Dicho de otro modo, toda la estructura es imprescindible para que la enzima tenga actividad y es un proceso complejo empezar a diseñar este tipo de moléculas grandes desde cero.
En este sentido, el desarrollo de la bioinformática y la biología estructural ha contribuido de manera importante. En la actualidad, la mecánica cuántica permite calcular el estado de transición de una reacción, simular la zona activa compatible y diseñar la estructura proteica que sería necesaria para completar la estructura.
Esta metodología ha permitido catalizar reacciones sin biocatalizador conocido y comprobar que es posible llevar a cabo este proceso. Además, estas técnicas han contribuido a ampliar nuestro conocimiento sobre la estructura de las proteínas. Sin embargo, las características catalíticas de estos ejemplos obtenidos no alcanzan el nivel de actividad de las enzimas naturales, por lo general, tienen una capacidad de catálisis más reducida [4].
En consecuencia, aunque hay mucho que mejorar, el diseño de nuevos biocatalizadores nos permite controlar la velocidad de cualquier proceso de nuestro interés. Estas técnicas permiten que los procesos industriales se realicen a temperaturas inferiores, sin necesidad de disolventes orgánicos, con mejor eficiencia, con menos agua y con menos residuos contaminantes. Por lo tanto, podemos diseñar los nanombres de la vida para que los procesos industriales sean compatibles con la vida.
Bibliografía
[1] Albert L. Lehninger, David L. Nelson y Michael M. Cox. Fundamentos de Bioquímica (2008), Universidad del País Vasco, 1ª edición.
[2] Po-Ssu Huang, Scott E. Boyken y David Baker. - Nature (2016), 537 (7620):320-7.
[3] Karlheinz Drauz, Harald Gröger y Oliver May. Enzyme catalysis in organic synthesis (2012), Wiley-VCH.
[4] Kiss G, Çelebi-Ölçüm N, Moretti R, Baker D, Houk KN. Computational enzyme design. Angewandte Chemie International Edition in English (2013), 52(22):5700-25.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia