La evolución de los biomateriales puede hacer realidad lo que parecía increíble
2010/11/01 Orive Arroyo, Gorka - Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzaileaFarmazia Fakultatea UPV-EHU, Vitoria-Gasteiz | Zarate Sesma, Jon - Farmazian doktorea. Biofarmazia, Farmakozinetika eta Farmazia-teknologiako irakasle kolaboratzaileaFarmazia Fakultatea UPV-EHU, Vitoria-Gasteiz Iturria: Elhuyar aldizkaria
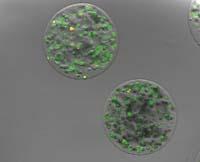
La incidencia de enfermedades neurodegenerativas en las sociedades desarrolladas ha aumentado en las últimas décadas. Y a pesar de que se están probando muchos fármacos que pueden proteger o recuperar neuronas, existen una serie de obstáculos para su desarrollo y administración clínica. Entre los obstáculos se encuentran: (1) superar la barrera hematoencefálica y llegar al cerebro otro fármaco necesario; (2) proteger al fármaco de la degradación rápida de las enzimas presentes en la sangre; (3) llegar al fármaco a las células afectadas específicamente; (4) aumentar la duración y la biocompatibilidad de las células disponibles para la terapia; y (5) demostrar plenamente la seguridad y eficacia del sistema a inyectar o inyectar en el sistema nervioso central.
Con el objetivo de superar estos problemas, los científicos están realizando grandes esfuerzos para desarrollar biomateriales. En concreto, se está trabajando en el diseño de nano y microsistemas transportadores fabricados con biomateriales poliméricos que liberan factores neurotróficos (NGF, GDNF,...) a la zona lesionada. Cinco son los sistemas más importantes investigados:
1. Liposomas: vesículas formadas por doble capa lipídica.
2. Nanoesferas y nanocápsulas: Son vesículas esféricas realizadas con polímeros biodegradables sólidos convencionales.
3. Dendrimeros: son redes poliméricas tridimensionalmente perfectas formadas por moléculas interconectadas alrededor del núcleo central.
4º Micelas: Son grupos esféricos formados por moléculas anfifílicas como el colesterol.
5. Microcápsulas poliméricas tridimensionales que transportan células: Son cápsulas formadas por una capa semipermeable que permite la introducción de nutrientes y oxígeno y la eliminación de residuos celulares. Por su facilidad de gelificación y su naturaleza porosa, el alginato es el polímero más utilizado en la formación de estas microcápsulas.
Estos sistemas transportadores están optimizados para que la liberación del fármaco sea más efectiva y la biodegradación sea menor gracias a los recubrimientos moleculares específicos de la superficie. Esta es la principal ventaja. Además, los resultados de las investigaciones preclínicas realizadas con estos sistemas han sido muy esperanzadores.
Entre los sistemas mencionados, las microcápsulas que transportan células presentan algunas ventajas. De hecho, aseguramos la síntesis de factores neurotróficos de novo durante la vida de las células, es decir, cuando el factor es necesario se sintetiza en el momento y además en el interior del paciente. Ejemplo de ello es el ensayo clínico iniciado en 2006 en EEUU para tratar la enfermedad neurodegenerativa de la retinitis pigmentosa. En este ensayo han descubierto que las neuronas ciliares degeneradas de la retina pueden ser recuperadas debido a la liberación de factores neurotróficos ciliares por parte de las células epiteliales primarias de la retina encapsulada. Cabe destacar el ensayo III. que pasó a fase en 2009 y que en breve podría comercializarse como medicamento.
Sin embargo, todavía es necesario introducir mejoras significativas en las microcápsulas que transportan células. Hay que tener en cuenta que el desarrollo de estos sistemas es mucho más complejo que el desarrollo de otros. Por un lado, la necesidad de diseñar cápsulas que permitan un adecuado intercambio de nutrientes, residuos y gases para mantener las células vivas. Y por otro, porque para garantizar la seguridad es necesario optimizar los procesos de fabricación.
Otra de las estrategias de interés que se está utilizando en las enfermedades neurodegenerativas es la implantación de biomateriales que simulan el comportamiento del tejido sano en el propio lugar de la lesión, a pesar del alto riesgo de afección a las zonas sanas del cerebro. En esta estrategia, además de utilizar células primarias, se han obtenido interesantes resultados con células madre. Un claro ejemplo de ello es el ensayo preclínico realizado por Park y miembros con ratones en 2002. En este ensayo se intentó recuperar la parte del cerebro muerta por interrupción del caudal de oxígeno (isquemia). Para ello se procedió a la encapsulación de células madre neuronales y a la implantación directa de biomaterial en la zona afectada. Descubrieron que en torno al biomaterial se producía un nuevo tejido nervioso formado por células madre, y no sólo eso: las nuevas neuronas establecieron conexiones (neuritas) con otras neuronas sanas del huésped.
Un grupo de investigadores de la Universidad Emory de Atlanta también obtuvo buenos resultados en 2009. Los ratones con lesión cerebral fueron trasplantados con células madre neuronales en un biomaterial fabricado con proteínas laminina y fibronectina que imitan el medio biológico, y vieron que fueron capaces de desarrollarlo, mejorando la pérdida de algunas funciones cerebrales.
Aunque los resultados obtenidos con los animales son totalmente positivos, no se puede olvidar que trabajar con animales y personas es totalmente diferente. Cuando experimentamos con animales utilizamos más de un animal para demostrar que los resultados son repetitivos y que sean creíbles. Del mismo modo, cuando diseñamos el experimento, se realiza un cálculo de los animales que van a morir para obtener la autorización del comité de ética. Pero en el ser humano es la única opción y no podemos equivocarnos. Es decir, en los miles de ensayos preclínicos que primero se han realizado previamente hay que definir bien todos los detalles, para después realizar una única prueba en el ser humano para sacar bien el experimento.
Y para ello hay que cumplir muchos requisitos. De hecho, el biomaterial perfecto para el tratamiento de enfermedades cerebrales debe ser adaptable, biocompatible, biodegradable, químicamente y mecánicamente estable, no tóxico, procesable, capaz de controlar la cinética de liberación del fármaco e interactivo con las células del huésped. Parece que la capacidad de imitación de la matriz que rodea las células del cuerpo es una de las claves para que los biomateriales sean eficientes, por lo que se están probando adaptaciones químicas y físicas en las superficies de los sistemas transportadores, buscando un sistema inteligente interactivo con las células del huésped.
Por último, consideramos que dentro de unas décadas no sería un despropósito tener entre manos un medicamento eficaz de biomateriales para alguna enfermedad neurodegenerativa y hacer realidad lo que hace tres décadas parecía increíble.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia





