Botika bioantzeko berrien erronka
2014/11/01 Calvo Hernáez, Begoña - Farmazian eta Farmazia Teknologian katedradunaFarmazia Faktultatea. EHU Iturria: Elhuyar aldizkaria
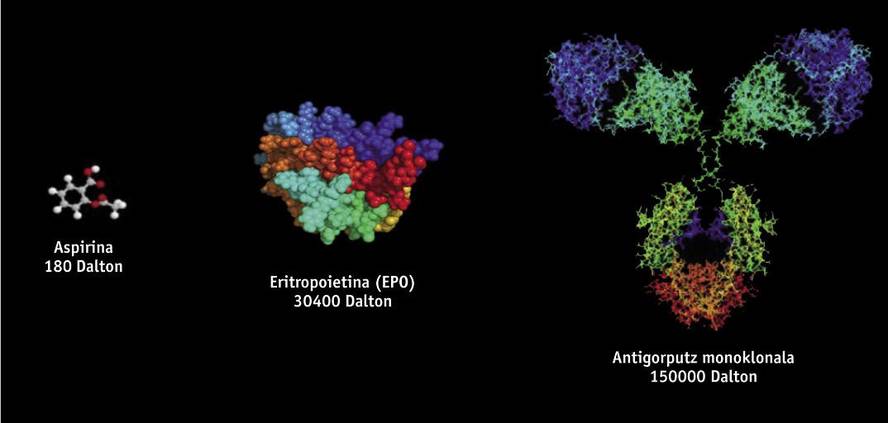
Botika bioteknologikoek egitura proteikoa dute, eta ingeniaritza genetikoko tekniken bitartez lortzen dira (adibidez, DNA birkonbinatuaren bidez); beraz, oso zaila da haiek aztertzea eta haien ezaugarriak zehaztea, sintesi kimiko bidez lortzen diren botika generikoak ez bezala. Botika bioteknologikoak lortzeko, genetikoki aldatutako organismo bizidunak erabiltzen dira, hala nola bakterioak, legamiak eta animalia- eta landare-jatorriko zenbait zelula-lerro. Fabrikazioan zelula-lerro eta ekoizpen-prozesu desberdinak erabiltzen direnez, ez daude erabat berdinak diren jatorri biologikoko bi produktu. Hori dela eta, jatorrizko medikamentuen kopia berdintsuak baina ez guztiz berdinak direnez, generikoen araudia ez da zientifikoki egokia bioantzekoentzat. Molekularen bariazio txikiek edo fabrikazio-prozesuko aldaketa txikiek eragina izan dezakete emaitzan eta azken produktuan, eta, beraz, araudi espezifikoa behar du haien fabrikazioak.
Kalkulatzen da jatorrizko produktuak baino % 20 merkeagoak direla botika bioantzekoak; generikoekin baino aurrezki txikiagoa lortzen da, beraz, haiek % 40 merkeagoak baitira jatorrizkoak baino. Nolanahi ere, aurrezkiaren ehunekoa txikiagoa bada ere, terapia garestietan erabiltzen direnez, haiek praktika klinikoan sartzeak abantaila handia ekarriko du osasun-sistemara, eta pazienteek eskurago izango dituzte terapia garestiak.
Bestalde, bioantzekoak merkatuan sartzean, lehia handitu egingo da, eta horrek, logikoa denez, horrelako produktuen prezioa jaistea ekarriko du. Hala, osasun-arloko aurrekontuak jasangarriagoak izango dira, eta zenbait baliabide beste helburu batzuetarako erabili ahal izango dira, hala nola osasun-arloko ikerketa-lerroak bultzatzeko.
Bioantzekoak Europan
Europan orain arte onartu diren botika bioantzekoen artean, askotariko produktuak daude; besteak beste, hazkundearen hormona, eritropoietina (EPO) eta interferona. Oraintsu, gainera, antigorputz monoklonalen lehen bioantzekoak onetsi dituzte, hala nola infliximaba, zeina gaixotasun autoimmuneak tratatzeko erabiltzen baita (gaixotasun erreumatologikoak, psoriasikoak eta Crohn-en gaixotasunari lotuak, besteren artean). Antigorputz monoklonalak hasierako bioantzekoak baino molekula are konplexuagoak dira, eta uste izatekoa da “izugarrizko eragina” izango dutela. Kalkulatu dutenez, 2020a bitartean hogei mila milioi euro aurreztu litezke antigorputz monoklonal bioantzekoak erabilita.
Espainian, onartutako bioantzekoen ezarpena ez da berdina kasu guztietan: bioantzeko batzuek % 50eko ezarpena lortu dute (filgrastimak esaterako, zeina erabiltzen baita kimioterapiarekin tratatutako paziente onkologikoen defentsa-gutxitzeari aurre egiteko); beste batzuek ezarpen txikiagoa lortu dute: esate baterako, eritropoietinek % 20ko ezarpena lortu dute gutxi gorabehera, eta hazkundearen hormonak % 5 ingurukoa.
Europan zentralizatutako prozedura baten bidez onartzen dira bioantzekoak gure inguruan. Sendagaien Europako Agentzia (EMA, ingelesez) arduratzen da zehazteaz produktu horiek zer baldintza bete behar dituzten Europar Batasunean merkaturatzeko. Bioantzekoei buruzko lege-esparrua 2004an argitaratu zuen EMAk, eta, geroztik, kalitate-mailaren gaineko eskakizunei buruzko zenbait gida eta arau argitaratu dira, bai orokorrak bai produktu bakoitzarentzako espezifikoak, baita produktuak onetsi aurretik egin beharreko saiakuntza aurreklinikoei eta klinikoei buruzkoak ere. EMA aitzindaria izan da munduan bioantzekoak baimentzeko horrelako araudiak finkatzen. Hain zuzen, Europako araudian oinarritu dira beste eskualde eta herrialde garatu batzuk beren araudiak argitaratzeko: Australia, Japonia eta abar. Gauza bera gertatzen da Osasunaren Mundu Erakundeak (OME) eta Estatu Batuetako Elikagaien eta Sendagaien Agentziak ezarritako jarraibideekin ere (azken erakunde hori bioantzekoei buruzko lehen jarraibideak onartzeko fasean dago).
Azkenik, botika biologikoen kopia horiek agertzean, generikoak agertu zirenean bezala, eztabaida sortu da haiek jatorrizko botiken kalitate, eraginkortasun eta segurtasun bera izan dezaten bermatzeko aukerak direla eta. Horrelako farmakoak agintzeko ardura duten medikuek jakin behar dute bioantzekoek ez dutela baimenik lortzen baldin eta aurrez frogatzen ez bada jatorrizko produktuekin konparagarriak direla. Horretarako, kontrol eta eskakizun zorrotzak ezartzen ditu EMAk. Beraz, funtsezkoa da horrelako farmakoak agintzen eta erabiltzen dituzten osasun-arloko langileek informazio zientifiko, zehatz eta sendoa izatea tratamendu horien berezitasunei buruz.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia