Cando Einstein chocou coa luz
2005/09/01 Kortabitarte Egiguren, Irati - Elhuyar Zientzia Iturria: Elhuyar aldizkaria

En 1905, Einstein explicou o efecto fotoeléctrico. Paira iso tivo que basearse na teoría dos cantos. Paira analizar a historia do descubrimento do cuántico, primeiro hai que mirar cara atrás. É preciso analizar o debate sobre a natureza da luz.
En 1801 o físico inglés Tomás Young quixo comprender mellor o que é a luz. Até entón, Newton dicía que a luz estaba formada por pequenas partículas. Pero Young fixo pasar a luz por dúas rendijas e, do mesmo xeito que as ondas flotantes, viu que se difractaba. Por tanto, deduciu que a luz é a onda. Einstein deu a razón a ambos os cando explicou o efecto fotoeléctrico.
Efecto fotoeléctrico
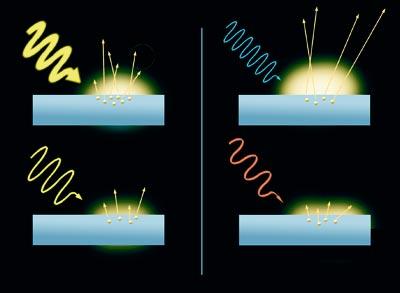
É un efecto curioso. Cando os raios de luz impactan sobre a superficie dun metal, fan que se extraian os electróns. Este é o efecto fotoeléctrico. Ademais, o resultado varía en función da cor dos raios. Os electróns liberados pola luz azul móvense máis rápido que os liberados pola luz vermella. De feito, canto maior é a enerxía do raio de luz (a da luz azul é maior que a da vermella), máis rápido é o movemento dos electróns. Por outra banda, o número de electróns liberados do metal depende da intensidade da luz, a maior intensidade da luz, maior número de electróns. Con todo, a luz non libera electróns sen ter una enerxía mínima.
Partiu da teoría de Einstein Planck. Esta teoría ten en conta que a luz é a onda, que ten una frecuencia e que a frecuencia é proporcional á enerxía.
A onda é un exemplo sinxelo. A frecuencia é o intervalo de tempo entre unha onda e a seguinte; canto maior é o intervalo, menor é a frecuencia. Volvendo á luz, a luz vermella ten menos frecuencia que o azul, polo que, segundo a teoría de Planck, a enerxía é moito menor. De feito, os electróns fortemente unidos non poden ser liberados por radiacións de baixa frecuencia. Requiren moita enerxía.

Así, en 1905 deu una explicación detallada do efecto fotoeléctrico. Asumindo que os electróns que se liberan teñen certos niveis de enerxía, como Planck, o mozo Albert Einstein propuxo que coa radiación ocorre o mesmo. Einstein deuse conta de que ambas as enerxías están unidas no efecto fotoeléctrico, polo que o choque debe interpretarse como un choque entre dúas partículas, é dicir, que a luz actúa como una bóla de billar. Chamou fotón á partícula de luz e reclamou que a enerxía do fotón é proporcional á frecuencia da luz, como no caso da onda. Por tanto, segundo a hipótese de Einstein, a luz é á vez partículas e ondas.
Esta é a explicación pola que Einstein foi galardoada co Premio Nobel de Física de 1921 e non pola teoría da relatividad, aínda que, sen dúbida, aquela teoría e o resto das súas achegas á física foron importantes. Probablemente gañen o premio Nobel.

O traballo gañador do Premio Nobel de Física titúlase: Über einen die Erzeugung und Verwandlung deas Lichts betreffen heuristischen Gesichtspunkt (Desde unha perspectiva heurística, sobre a produción e transformación da luz). Ademais de dar una explicación do efecto fotoeléctrico, é una obra básica paira a física cuántica, moi revolucionaria, segundo o autor.
Con todo, aínda que Einstein tivo una gran importancia nos inicios da teoría cuántica, a verdadeira revolución da cuántica foi XX. Comezou no segundo cuarto do século e Einstein non o fixo.
Einstein dixo que a luz non só pode actuar como onda, senón como partícula, mentres que Louis de Broglie afirmou que as partículas tamén poden actuar como ondas. Pero, que significaba iso? Que calquera materia ten natureza ondulatoria. Iso si, podes xogar como ondas as túas cadeiras, cans, árbores ou ti mesmo. Loxicamente, cando se trata de corpos moi grandes, a natureza ondulatoria non ten forza, polo que este efecto non se nota na materia que vemos, pero si a nivel atómico e menor. É dicir, si un fai de electróns faise pasar por unha parede con dúas ranuras, como as ondas do mar (e non como as bólas do billar) interferirán entre si, é dicir, comportaranse en forma de ondas. Proba diso son algunhas das técnicas máis estendidas na actualidade como o microscopio electrónico.

partículas e ondas.
A partir dese momento non podemos distribuír o concepto de partícula e onda. Non. Pódese dicir que son dúas perspectivas do mesmo concepto. Nalgúns casos a materia aparece en forma de partículas ou corpúsculos e noutros en forma de ondas. Pasaron anos ata que os físicos aceptaron esas conclusións.
Este traballo foi a base da nova rama da física desenvolvida grazas á teoría do canto: a física cuántica. A achega de Einstein tómase como o verdadeiro punto de partida da física cuántica, xa que Planck só achegou o concepto de canto. Posteriormente, a partir do traballo de Planck e Einstein, outros moitos físicos deron una interpretación sorprendente á física cuántica.
Saltar aos átomos
Entre os que deron un novo rumbo á teoría do cuántico, destaca Niels Bohr. O físico danés aplicou aos átomos a teoría que se aplicaba á radiación. É dicir, cultivou o modelo atómico. Na súa opinión, os electróns dos átomos non podían ter calquera enerxía. Ao redor do núcleo movíanse en varias manchas, cada una delas cun nivel de enerxía determinado. Canto máis preto estea o electrón do núcleo, máis enerxía é necesaria paira evacualo.
O modelo atómico de Bohr é planetario, é dicir, os electróns viran en órbita ao redor do núcleo. Segundo Bohr, as órbitas electrónicas son estables e prodúcense en determinados niveis enerxéticos, é dicir, as súas enerxías están cuantificadas.

Por exemplo, cando o hidróxeno quéntase nun recipiente pechado e transparente, emite luz que se chama espectro de emisión de hidróxeno. O modelo de Bohr explica moi ben por que a luz emitida é de certas cores ou frecuencias, e non branca (se se emitisen todas as cores de luz sería branca). Todo iso está relacionado cos niveis de enerxía discreta ou cuantizada dos electróns.
Con todo, o modelo de Bohr só pode explicar o espectro do hidróxeno. Aínda que adecuado paira o átomo de hidróxeno, non era capaz de explicar o espectro atómico dos sistemas compostos por dous electróns. De feito, o modelo de Bohr só mostraba átomos dun só electrón. E, con todo, non é pouco, non cho penses! Pola contra, grazas a Bohr abríronse as portas e o resto de físicos puideron analizar átomos máis complicados.
A revolución cuántica tardou 15 anos máis en aparecer os espectros atómicos dos elementos multi-electrón. Isto supuxo, ademais, a desaparición do modelo atómico planetario.
En 1926, Schrödinger publica a soada ecuación que leva o seu nome. O modelo atómico planetario superouse, pois esta ecuación pon de manifesto que os electróns se comportan en forma de onda nos átomos. Por iso, non se pode falar de órbitas de electróns, xa que una onda non se atopa nun lugar físico determinado, senón nunha área máis ampla. E a isto non se lle chama órbita, senón orbital. É dicir, o orbital dános a probabilidade de atopar electróns nun lugar. Por tanto, en lugar de falar das órbitas dos electróns, hai que falar da probabilidade de atopar electróns.
Sen ningunha dúbida, todas estas teorías son froito dos traballos realizados por Planck e Einstein. A física teórica deu grandes pasos, pero non quedou nunha mera teoría. Tivo moitas aplicacións. Estas apps sorprenderían tamén a Einstein.
Fisión, filla da relatividad
Pegada nas novelasNa actualidade parece que os Premios Nobel de Física están máis distribuídos, por dicilo dalgunha maneira. De feito, nos últimos anos premiáronse obras de diferentes áreas da física, como as de superconductores, neutrinos cósmicos, condensados Bose-Einstein, etc. Todos son temas moi diferentes. Antigamente, co paso do ano, os temas relacionados co efecto fotoeléctrico ou a natureza do átomo foron os que máis premios recibiron. Todo comezou en 1918 con Planck.. En 1921 Einstein recibiu o Premio Nobel de Física pola explicación do efecto fotoeléctrico. Con todo, o efecto fotoeléctrico e a física cuántica non quedaron intactas. Os físicos seguiron traballando e con bos resultados. Ao ano seguinte, en 1922, Bohr recibiu o Premio Nobel de Física. Einstein aplicou a teoría aplicada á luz aos átomos, é dicir, propuxo o modelo atómico. En 1923, Millikan recibiu, entre outras cousas, o premio por confirmar as dúas teorías anteriores. En 1925 foi recollido por Franck e Hertz por estudar os choques entre os electróns e os átomos. Foi doada a Broglie en 1929 por descubrir a natureza ondulatoria dos electróns. Segundo isto, ademais da luz, calquera materia pode actuar como onda. En 1932, pola vía da mecánica cuántica, tamén foi premiado Heisenberg. En 1933, Schrödinger e Dirac foron premiados por desenvolver o modelo atómico exposto por Bohr. O primeiro, por exemplo, escribiu a ecuación matemática que daba forma de onda ou información de calquera partícula. Como se pode observar, a pegada do efecto fotoeléctrico nos premios Nobel de Física non é pequena. É significativo. Durante varios anos foron premiados traballos relacionados directa ou indirectamente con este tema. |




