¿Si la gestación cura el corazón?
2018/03/01 Redondo Angulo, Ibon - Biomedikuntzan doktorea Iturria: Elhuyar aldizkaria
El corazón de los mamíferos tiene como única función bombear la sangre a través del aparato circulatorio para hacer llegar al propio corazón y al resto de los órganos los nutrientes y el oxígeno. La tarea es única, pero no lenta. Las situaciones que se dan a lo largo de la vida animal presentan exigencias energéticas muy variadas que el corazón debe cumplir.
Para satisfacer estas mayores exigencias energéticas, el corazón tiene que trabajar más y eso tiene una consecuencia: más estrés en las paredes del corazón. Si este incremento persiste durante un periodo de tiempo, el corazón puede poner en marcha un mecanismo para reducir el estrés ventricular y mantener o aumentar la capacidad de bombeo. Lamentablemente el nombre del mecanismo es conocido: la hipertrofia cardiaca.
Hipertrofia cardiaca
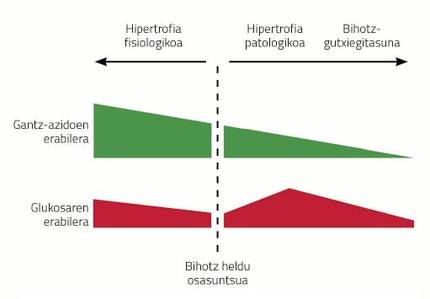
La hipertrofia cardiaca es consecuencia de enfermedades como la hipertensión, el infarto producido por la isquemia de las arterias coronarias o la obesidad. Este tipo de hipertrofias se denominan hipertrofias patológicas y tienen ciertas características. Por ejemplo, el metabolismo del corazón cambia radicalmente con la hipertrofia del corazón. A diferencia del cerebro, el corazón utiliza principalmente ácidos grasos (60-70%) como fuente de energía y el resto lo obtiene del metabolismo de la glucosa. Al enfermar el corazón, el uso de las fuentes de energía cambia radicalmente; la glucosa se convierte en la principal fuente de energía en el corazón hipertrofiado y los ácidos grasos se descartan. Si el estrés crónico que recibe el corazón hipertrofiado no desaparece, el corazón aumenta aún más, aparece más fibrosis y se produce inflamación disminuyendo la capacidad de bombeo. Además, a medida que la enfermedad avanza, el corazón deja de utilizar glucosa, característica de la insuficiencia cardiaca.
Las enfermedades cardiovasculares son las más frecuentes en la sociedad actual y muchas de ellas tienen el síntoma de un aumento del corazón. La hipertrofia cardiaca se transforma a menudo en una insuficiencia cardiaca que, desgraciadamente, todavía no tiene remedio. Por ello, la insuficiencia cardiaca es una de las causas más comunes de muerte en las sociedades industrializadas.
En numerosos estudios biomédicos en esta materia se están ensayando para descubrir y comprender los mecanismos moleculares mediante los cuales la hipertrofia cardiaca se convierte en insuficiencia cardiaca. De esta forma se podrían desarrollar nuevos episodios terapéuticos para evitar la hipertrofia del corazón o para que el corazón hipertrofiado vuelva a su estado sano, todo para evitar la insuficiencia cardiaca. Pero ¿por dónde empezar, cómo hacer un órgano hipertrofiado para volver a su función y estado anatómico normal? Para ello no debemos buscar muy lejos o en profundidad, las hembras pueden tener respuesta, las hembras gestantes.
Hipertrofia cardiaca por gestación
La gestación es un proceso complejo, incluso biológico. La fecundación inicia numerosos cambios profundos en el organismo de una hembra. Todos estos cambios van a permitir que de la unión de las dos células surja un nuevo miembro de una especie.
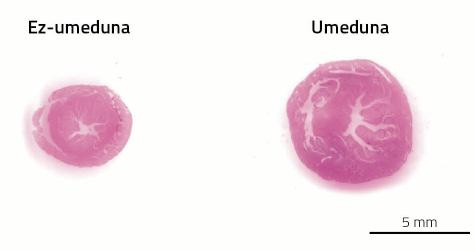
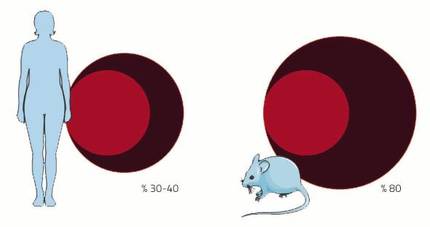
El sistema cardiovascular es uno de los sistemas que sufrirá muchos cambios durante la gestación. La causa es la placenta. Como si fuera poco el nacimiento de un nuevo niño, la gestación tiene otro hecho maravilloso: crear un nuevo órgano dentro de un cuerpo adulto. Este nuevo órgano necesita, al igual que el resto, un suministro de sangre. Para ello, la red arterial y venosa se prolongará hasta la plazenta para suministrar sangre a la placenta. Además, se incrementará el volumen de sangre para llenar el nuevo aparato de circulación prolongado. En las mujeres el volumen de sangre aumenta entre un 30-40%, casi el doble que en el ratón un 80%. Y es que, como en cada gestación los ratones tienen tantas placentas como crías, su demanda de sangre es mayor.
El problema es que el corazón tiene que bombear más sangre desde un sistema de tuberías de arterias y venas más largo. Como se ha comentado anteriormente, la gestación es una de las situaciones de la vida animal en las que el corazón tiene que trabajar más. Como consecuencia, las hembras gestantes desarrollan una hipertrofia cardiaca. Este tipo de hipertrofia, por su parte, se denomina beneficiosa o fisiológica. En este caso, el corazón no expresa fibrosidad, y el metabolismo no selecciona glucosa sino todo lo contrario, se basa más en ácidos grasos (ver figura 3).
Tras el parto, al igual que la placenta, los cambios fisiológicos derivados del embarazo desaparecen. También hipertrofia del corazón. En el caso de los ratones, entre 7 y 14 días después del parto, el corazón es capaz de recuperar su tamaño original; en las mujeres el proceso se alarga durante un año.
Ahí está la cuestión. ¿Cómo excluye el corazón de una hembra gestante de hipertrofia? ¿Por qué no es posible restaurar la hipertrofia cardiaca que se produce en varias enfermedades? ¿Qué podemos aprender de la hipertrofia beneficiosa de la gestación para curar hipertrofias patológicas? En respuesta a todo ello, las investigaciones realizadas en nuestro laboratorio han descrito 2 factores relacionados con la hipertrofia gestacional:
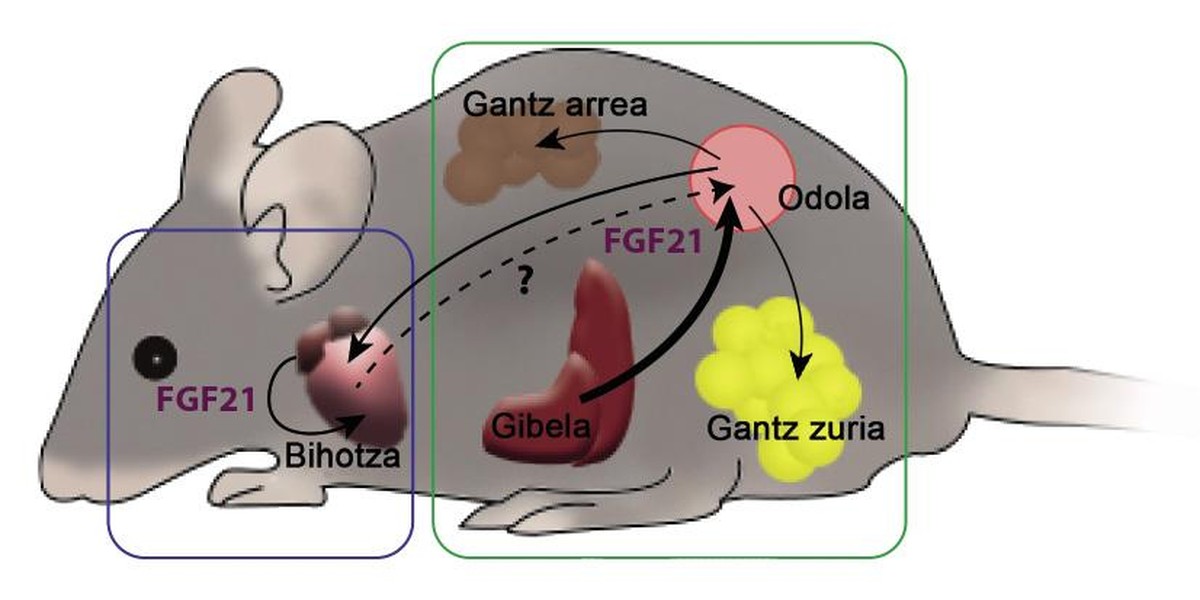
? El primer factor es el FGF21, factor de crecimiento de los fibroblastos 21. En el año 2000 un grupo de científicos japoneses descubrió este factor como hormona. El factor FGF21 se genera principalmente en el hígado, después viaja por la sangre hasta llegar a sus tejidos diana, donde produce diversos efectos. Uno de ellos es el tejido adiposo marrón o grasa parda. Esta hormona promueve el consumo de ácidos grasos. En general, el FGF21 es un factor capaz de estimular el metabolismo, por lo que quizá la hormona se haya presentado también como fumador de grasas. Algunos laboratorios también trabajan para utilizarlas como herramienta anti-diabetes. Los roedores diabéticos tratados con FGF21 presentaban mejores niveles de glucosa o glucemias, a la vez que recuperaban la sensibilidad a la insulina perdida y reducían el peso y los triglicéridos en sangre.
La relación entre FGF21 y el corazón ha sido desconocida hasta hace 5 años. Entonces publicamos cómo el FGF21 era beneficioso también para el corazón. A los ratones se les generó una hipertrofia patológica del corazón mediante un fármaco. En estos corazones aparecía la fibrosis, la inflamación y la indicación restringida de los genes que rigen el consumo de ácidos grasos. A otro grupo de ratón, además del fármaco, se les insertó el FGF21, lo que provocó una menor hipertrofia cardiaca. El grado de inflamación y la expresión de los genes también había mejorado respecto a los animales que sólo recibieron el fármaco. Además, entre los descubrimientos, demostramos que el corazón tiene la capacidad de producir FGF21, lo que permitiría al corazón influir en él el FGF21 que él mismo ha creado.
Durante la gestación se produce una mayor expresión fisiológica del FGF21. El hígado y también el corazón generan un factor, por lo que el grado de FGF21 medible en la sangre de una hembra gestante es mucho mayor que el de una hembra no gestante. Además, atendiendo al consumo de ácidos grasos del corazón, durante la gestación es mucho mayor, lo que supone una hipertrofia beneficiosa. En otro grupo de experimentos se trabajó con ratones incapacitados para crear el FGF21, de manera que, a pesar de estar despierto, las hembras no podían aumentar el nivel sanguíneo del factor. De ello se dedujo que la capacidad de utilizar ácidos grasos estaba reducida. El FGF21, por tanto, es necesario para llevar a cabo la sobrecarga de trabajo que la gestación exige al corazón, ya que el corazón necesita FGF21 para consumir más ácidos grasos.
? El segundo factor descrito es un factor de transcripción cuya función es canalizar la expresión de otros genes. Al analizar las hembras gestantes, destacamos que la presencia de este segundo factor era sólo en el corazón. Al ser tan específica esta sobreexpresión del corazón, nos pareció que había que tener una razón detrás. El factor C/EBPb es un factor estrechamente relacionado con la respuesta inmune y la inflamación, ya que es clave para la activación de macrófagos. Los macrofagos son células que intervienen en el proceso inflamatorio y pueden ser de dos tipos: proinflamatorios (tipo M1), que iniciarán el proceso y antiinflamatorios (tipo M2), que resistirán el proceso.
Como ya se ha indicado, en el caso de hipertrofias patológicas se puede observar fibrosis e inflamación en los corazones, no así en las hipertrofias fisiológicas. En el caso de la gestación se describió que, siendo beneficiosa, la presencia de macrófagos tipo M2 era mayor que la de tipo M1. Si a las hembras gestantes se le quita la mitad de la capacidad de usar C/NFU, ocurre lo contrario en los corazones: Predominan los macrófagos tipo M1. El corazón necesita C/EBPb para activar los M2 macrófagos y combatir la inflamación.
El corazón tiene, por tanto, mecanismos y caminos para hacer beneficiosa una situación que debería ser patológica y permitir una carga de trabajo más elevada de lo normal, así como la posterior eliminación de la hipertrofia. Es más, estos mecanismos de fecundación y los demás que están por descubrir son capaces de proteger el corazón. Un par de estudios revela cómo los corazones de roedores niños eran más resistentes a un fármaco que produce fibrosis, y cómo los daños producidos tras un infarto eran menores en los niños.
Cabe destacar que la mayor parte de la investigación biomédica que se realiza con ratas y ratones se realiza con animales machos, ya sea porque siempre se ha hecho así o porque las hembras deben guardarse para tener crías. A pesar de ello, en este ejemplo las hembras han sido la clave del avance hacia la hipertrofia y la insuficiencia cardíaca, ya que ellas son las únicas que han aportado la gestación.
Bibliografía
Trabajo presentado a los premios CAF-Elhuyar.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia