Alliberant el nus de malalties genètiques
2017/03/01 Garcia Etxebarria, Koldo - Genetikan doktoreaEHUko Genetika, Antropologia Fisikoa eta Animalia Fisiologia saila Iturria: Elhuyar aldizkaria

La base de moltes malalties, prop de 14.000, es troba en defectes genómicos. Aquestes malalties poden classificar-se en dos grans grups: d'una banda, quan un únic gen el provoca, es denominen malalties monogénicas o mendelianes; i per un altre, quan intervenen diversos gens, les denominades malalties genètiques complexes. El primer pas és descobrir quins són els gens relacionats amb les malalties, que és imprescindible per a trobar remei. A pesar que en els últims anys s'han produït grans avanços en el coneixement d'aquests gens defectuosos, la solució no és tan clara.
Les malalties causades pels únics gens, unes 4.000, van ser les primeres a analitzar-se. En seguir els patrons que prediuen les lleis de Mendel, és més fàcil trobar un gen relacionat amb la malaltia. Per a això s'analitza la distribució de la malaltia en una família i es classifica en funció d'ella.
Quan es produeix per un gen que es troba en un dels 22 cromosomes no sexuals, es diu malaltia autosómica. En els autosómicos dominants, l'única còpia defectuosa del gen és suficient per a desenvolupar la malaltia. Entre elles, les més freqüents són la hipercolesterolemia familiar (una de cada 500 nounats), la neurofibromatosi tipus I (una de cada 2.500) o la malaltia d'Huntington (una de cada 15.000).
En les malalties autosómicas recessives, les dues còpies del gen han de ser defectuoses per al desenvolupament de la malaltia. L'anèmia falciforme (una de cada 625), la fibrosi quística (una de 2.000) i la malaltia de Tay-Sachs (una de cada 3.000) són les malalties més esteses d'aquest tipus.
Quant als cromosomes sexuals, entre les malalties relacionades amb els gens situats en el cromosoma X es troben la distròfia muscular de Duchenne (una de cada 7.000) i l'hemofília (una de cada 10.000). En el cas del cromosoma I, no obstant això, són molt estranys i normalment provoquen esterilitat.
Encara que hem posat com a exemple les malalties monogénicas més esteses, la majoria de les malalties mendelianes són malalties estranyes, és a dir, menys d'una de cada 2.000 persones les sofreixen. No obstant això, es coneix el gen responsable. Quan se sospita que un pacient pateix una malaltia, es pot seqüenciar aquest gen concret i confirmar si té aquesta mutació coneguda (canvi de seqüència). No obstant això, pot ocórrer que no hi hagi aquesta mutació coneguda, és a dir, que aquest pacient tingui una nova mutació. Per a buscar aquesta nova mutació són molt útils les tècniques de seqüenciació de tot el genoma que s'han desenvolupat en els últims anys.
En l'actualitat som capaces d'obtenir la seqüència de la regió funcional de tots els gens (uns 20.000) d'una persona (el que es coneix com exoma) i d'analitzar les mutacions que aquests porten. És habitual que hi hagi certs canvis, ja que el material genètic de tots els éssers humans no és exactament el mateix; a més, la majoria dels canvis no interfereixen en la funció del gen. Però comparant l'exoma del malalt amb el dels seus pares es pot deduir quins canvis ha rebut dels seus pares i quins són nous, i quins d'ells poden tenir efectes adversos sobre la funció del gen.
D'altra banda, les complexes malalties genètiques estan més esteses en la població, però no és tan fàcil trobar els gens responsables d'aquestes. Malalties com l'asma, l'esclerosi múltiple o la diabetis. A més, malgrat el seu component genètic, a causa de la influència del mitjà, l'estudi de la malaltia és més complicat.
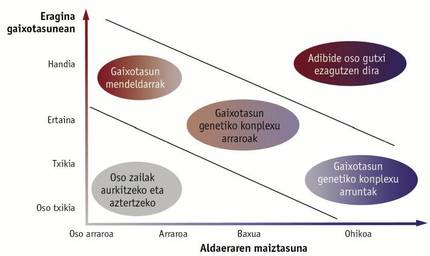
Per a identificar els gens implicats s'ha utilitzat la tècnica coneguda com a anàlisi associativa de tot el genoma. Mitjançant aquesta tècnica s'analitzen els marcadors genètics SNP (de l'anglès single nucleotide polymorphism, polimorfisme mononucleòtid) dispersos per tot el genoma. S'han desenvolupat eines per a analitzar simultàniament milers de marcadors d'aquest tipus, coneguts com a bioxip, la qual cosa permet conèixer de manera àgil i senzilla la varietat de SNPs que porta cada persona analitzada. Si una variant de SNP és més freqüent en persones amb malaltia que en persones sanes, es pot sospitar que aquesta variant està relacionada amb la malaltia. S'han realitzat prop de 2.400 estudis d'aquest tipus, que han associat de manera significativa gairebé 17.000 SNPs a una malaltia o característica complexa (Figura 1).
No obstant això, no som capaços d'identificar tots els gens associats a malalties genètiques complexes. Sabem que hi ha pocs gens que influeixen en la malaltia, però aquests no són suficients per a explicar completament el desenvolupament de la malaltia. Moltes malalties genètiques complexes són conseqüència de la combinació de molts SNP comunes, que eleven o redueixen lleugerament el risc de patir una malaltia (Figura 2). A més, aquest grup de SNP no té per què estar en un gen, és a dir, no té per què crear un error en un gen. Això dificulta la interpretació que un o diversos SNP estan relacionats amb una malaltia. Pot ser que aquests SNPs es trobin prop d'una mutació que realment produeix un error i no tinguin un efecte real. També pot ocórrer que l'SNP influeixi en la regulació del gen i que, encara que el gen no present defectes, no estigui a l'altura necessària. Encara queda molt per fer per a conèixer l'origen genètic de malalties genètiques complexes, i tot això serà un repte per al futur immediat.
Una vegada que siguem capaces d'establir l'origen d'una malaltia genètica, el següent repte seria trobar el seu remei. Fins al moment, les úniques solucions reeixides han estat la mitigació dels efectes de la malaltia o la prevenció de les condicions ambientals que la poden produir. De fet, la reparació directa dels defectes gènics, la teràpia genètica, no ha estat tan reeixida com volguéssim fins ara, per la qual cosa no s'ha generalitzat.
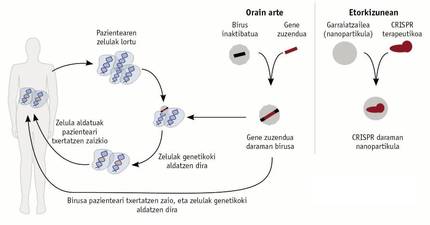
En aquells casos en els quals un gen determinat no és capaç de complir la seva funció, s'han realitzat assajos per a incorporar un gen que funcioni correctament en el material genètic d'alguns pacients (Figura 3). Per a això s'introdueix un gen funcional en un virus modificat, que és administrat al pacient com a tractament i integrat en el material genètic de les cèl·lules del pacient. Aquesta estratègia va començar a aplicar-se en alguns pacients amb una greu immunodeficiència combinada en 1990, però la seva eficàcia era a curt termini. Buscant una solució a llarg termini, es va millorar la tècnica i l'any 2000 es van realitzar nous assajos. Desgraciadament, com a conseqüència marginal d'aquests nous assajos, els pacients van desenvolupar una leucèmia que va provocar el seu abandó. Aquest efecte col·lateral tenia el seu origen en què el virus introduïa la còpia funcional del gen en un altre gen, la qual cosa generava leucèmia.
Des de 2015 sembla que vivim una resurrecció de les teràpies gèniques. Tècniques com el CRISPR, els dits de zinc són capaços d'evitar limitacions i problemes associats a l'ús de virus (Figura 3). Aquestes tècniques són capaces de conèixer el gen que es vol resoldre, per la qual cosa tenen una especificitat que els virus no tenen. Aquestes tècniques ja estan donant molt a dir i a curt termini donaran encara més. Haurà de comprovar-se la seva eficàcia.
El desenvolupament d'eines per a conèixer els fonaments de les malalties genètiques ens ha permès comprendre molt millor aquestes malalties i sembla que comencem a imaginar remeis eficaços. Encara que amb cautela, podem ser optimistes i pensar que en un futur pròxim viurem una revolució entorn de les malalties genètiques.
Bibliografia

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia