Énergie de la glace : hydrates de gaz
1988/12/01 Barandiaran, Mariaje | Irazabalbeitia, Inaki - kimikaria eta zientzia-dibulgatzaileaElhuyar Fundazioa Iturria: Elhuyar aldizkaria
Une grande partie de la surface terrestre est occupée par des hydrocarbures gazeux pris dans la glace. Les molécules de gaz sont stockées dans des boîtes de glace et on estime que la quantité de gaz naturel ainsi stockée peut être cent fois supérieure à celle sous forme de gaz libre. Bien que l'exploitation de ces hydrates de gaz pose des problèmes techniques, elle peut servir à satisfaire en partie les besoins énergétiques de notre civilisation.
Selon certains chercheurs, par exemple, le soviétique Juri Makogon pourrait expliquer la formation des planètes du système solaire par des hydrates de gaz. En outre, la comète Halley est composée d'hydrates de gaz.
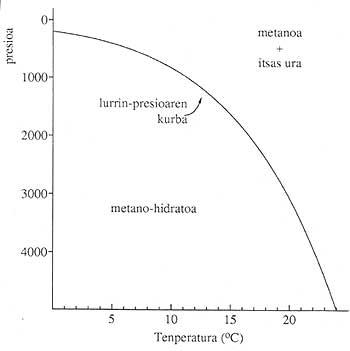
Les hydrates de gaz se trouvent dans de nombreuses parties de la surface terrestre (continents et océans), à condition que les conditions de pression et de pression soient adéquates. Nécessite des températures basses et des pressions élevées. 1. La figure montre les conditions de stabilité des hydrates de gaz formés dans les océans. Presque tous les gaz légers (méthane, éthane, oxydes de carbone (II)...) forment des composés solides avec des molécules d'eau et dans des conditions adéquates.
Un peu d'histoire
Les hydrates de gaz ne sont pas de nouveaux composés, car en 1810 le chimiste anglais bien connu Humphry Davy a obtenu par hasard un hydrate de chlore. Dans son laboratoire, à une température de 9ºC, il a obtenu des flocons d'hydrate de chlore mélangés à de l'eau chlorée. Ce n'est pas alors qu'il a pris connaissance.
Pendant des années, les hydrates de gaz ont été oubliés et marginalisés. Cependant, dans les années 1930, l'intérêt a réapparu dans son environnement, quand on a découvert que les obstructions des gazoducs des régions polaires étaient dues aux hydrates de gaz. Pour éviter l'obstruction des gazoducs il fallait déshydrater le gaz.
Cependant, le boom des hydrates de gaz remonte aux années 60, quand on a observé que les hydrates de gaz se trouvent à la surface terrestre et dans le sol des océans. Alors ils ont commencé à voir les hydrates de gaz comme source d'énergie.
Caractéristiques des hydrates de gaz
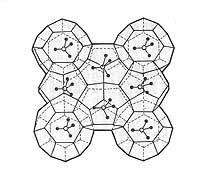
Selon les produits chimiques, les hydrates de gaz ont une structure de base tridimensionnelle. Cette structure forme des trous à l'intérieur comme une boîte, où le gaz est piégé. Les hydrates de gaz sont familiers appelés clatrates parmi les chimistes. Ces composés sont solides et ont une forme de glace ou de neige spongieuse.
Les gaz de taille moléculaire inférieurs à 0,69 nm produisent facilement des hydrates de gaz. Mais les gaz plus gros, comme le butane et l'éthane, ont besoin de molécules de gaz plus petites (comme le méthane) pour former un hydrate.
Deux types de structures sont connus dans les hydrates de gaz. Dans la structure appelée I, le gaz est piégé dans 46 molécules de glace et ne supporte que des gaz de petit diamètre moléculaire. L'autre structure, appelée II, admet des gaz de grand diamètre moléculaire et se compose de 136 molécules d'eau.
Les hydrates de gaz formés dans les gazoducs ont une structure généralement confuse. Une caractéristique très intéressante des hydrates de gaz est la vitesse de propagation des ondes sismiques en soi. Dans les milieux poreux saturés d'hydrates de gaz, la vitesse de propagation des ondes sismiques est entre 60 et 100% supérieure à celle des zones saturées de gaz libre. Cela permet de différencier la glace, les hydrates de gaz et le gaz libre, méthode utilisée pour trouver des hydrates de gaz dans les couches de sédiments.
Une autre caractéristique intéressante des hydrates est leur imperméabilité. Les hydrates de gaz sont très imperméables au gaz et à l'eau, plus imperméables que les argiles saturées d'eau qui travaillent comme couverture des puits de gaz et de pétrole. Cette auto-obstruction permet la formation de grands gisements d'hydrate de gaz dans le sol océanique.
Le méthane est le gaz le plus abondant dans les hydrates de gaz, mais on peut aussi trouver de l'éthane, du propane, du butane, du sulfure d'hydrogène et des gaz inertes.
Formation des hydrates de gaz
Il doit y avoir des conditions de pression et de température appropriées pour former des hydrates de gaz. Les meilleures régions de la Terre pour former des hydrates de gaz couvrent 25% des continents et 90% des océans. Donc, étant donné que 3/4 de la Terre sont couverts d'océans, il existe d'énormes réserves d'hydrate de gaz.
Les gaz naturels sont libres dans les trous et les fissures des roches sédimentaires, ou bien dissous dans l'eau, mais quand les conditions appropriées sont données, ils deviennent solides et précipitent comme des hydrates de gaz. Les études d'isotopes réalisées en hydrates de méthane présents dans les fosses du fond marin ont leur origine dans la décomposition de la matière organique.
Pour que cette formation se produise dans les régions appropriées pour la formation des hydrates de carbone, il est nécessaire d'assurer une quantité de gaz qui maintienne la saturation dans l'eau. Lorsque l'hydrate précipite sur le pore des sédiments, la concentration de gaz dans l'eau environnante diminue considérablement. Cette diminution de la concentration attire le gaz trouvé dans les pierres environnantes pour atteindre l'équilibre et ce gaz attiré se précipite en augmentant la concentration d'hydrate. C'est parce que les hydrates de gaz sont imperméables au gaz.
Exploitation des hydrates de gaz

Si les hydrates de gaz sont considérés comme source d'énergie, les méthodes d'exploitation des puits doivent être étudiées. Les puits d'hydrate de gaz peuvent être trouvés dans deux zones très différentes (en terre et mer), de sorte que les voies d'exploitation devront être différentes.
Dans les approches terrestres, il existe un axe général qui consiste à libérer le gaz de l'hydrate de gaz pour une utilisation ultérieure par des méthodes conventionnelles. Le changement de phase du gaz peut être effectué par différentes voies.
Si la pression diminue dans la fosse, les hydrates de gaz commencent à se décomposer. Des méthodes thermodynamiques et électroacoustiques peuvent également être utilisées. La décomposition des hydrates de carbone peut être obtenue en injectant de l'eau ou de la vapeur chaude. Bien qu'on ne sache pas exactement, l'énergie nécessaire pour libérer le gaz pris dans les hydrates n'est pas beaucoup plus grande que celle nécessaire pour fondre la glace. Certains croient qu'une partie du méthane libéré par la fosse peut brûler pour chauffer la fosse.
Les gisements sous-marins présentent des caractéristiques spéciales, car ils ne sont pas couverts par une couche de roche imperméable. En outre, ils sont très répandus dans le fond marin et leur profondeur peut varier d'un à cent mètres. Mais étant soumis à de grandes quantités d'eau, son exploitation à pression hydrostatique constante est possible indépendamment de la voie de décomposition de l'hydrate. Un autre facteur à prendre en compte dans les fosses sous-marines est qu'elles constituent normalement une couverture imperméable de fosses à gaz libre ou pétriole. C'est pourquoi, dans ce cas, il faudra exploiter le gaz libre ou le pétrole avant l'hydrate de gaz.
Les hydrates de gaz peuvent être une source d'énergie pour l'avenir, mais il ne suffit pas encore de ceux connus pour exploiter les hydrates de gaz. Dans le monde entier et surtout en Union soviétique, on étudie cet aspect.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia





