Coqueluche: un regard de près
2023/09/01 Amuategi Aulestiarte, Jone - Biokimika eta Biologia Molekularra saila (EHU). Biofisika Institutua (UPV/EHU-CSIC) | Alonso Estrada, Rocio - Biofisika Institutua (UPV-EHU-CSIC), Biofisika Bizkaia Fundazioa | Ostolaza Etxabe, Helena - Biokimika eta Biologia Molekularra saila (EHU). Biofisika Institutua (UPV/EHU-CSIC) Iturria: Elhuyar aldizkaria
La toux fermentable est une infection respiratoire causée par la bactérie Bordetella pertussis et potentiellement mortelle pour certaines populations. Bien que les campagnes de vaccination au niveau mondial aient contribué à atténuer la situation, les augmentations sont enregistrées tous les 3-5 ans. Sans aller plus loin, Osakidetza a annoncé une comparution à Gipuzkoa en juin 2023. Dans cette revue, nous avons travaillé sur la maladie, la bactérie et ses facteurs de virulence.

En 2019, les infections des voies respiratoires basses ont tué 2,4 millions de personnes dans le monde [38], les plus touchées étant les enfants de moins de 5 ans et les personnes âgées [43]. Les responsables de ces infections sont des virus et/ou des bactéries pathogènes, comme la bactérie de la pneumonie qui cause près de la moitié des décès [29, 43]. Nous ne pouvons manquer de mentionner les virus de la famille Coronaviridae, responsables du rhume et des maladies SARS, MERS ou COVID-19. Dans cette revue, en tout cas, nous avons assisté à une toux féroce provoquée par Bordetella pertussis.
Retour d’une maladie ancienne
La coqueluche est une maladie avec un nom curieux. Cependant, il déconnecte bien le son que les personnes infectées produisent en respirant entre un épisode de toux et le suivant. Bien qu'il puisse initialement ressembler à la toux conventionnelle, les symptômes peuvent durer des semaines ou des mois. Il peut provoquer des difficultés respiratoires, des épisodes brusques de toux et de fièvre, entre autres. L'apnée est également fréquente chez les bébés. Si la maladie n’est pas surmontée au début, dans les cas les plus graves, elle peut provoquer la mort par pneumonie chez 90% des patients [23].
Cette infection continue d’affecter et de tuer de nombreux enfants dans le monde, mais elle peut éviter les vaccins [16]. Selon le dernier rapport publié par l'Organisation mondiale de la santé (OMS), avant que les vaccins contre la coqueluche ne soient disponibles, c'était l'une des maladies les plus fréquentes chez les enfants. Dans les années 1950 et 1960, les campagnes de vaccination de haut niveau ont entraîné une diminution de l'incidence et de la mortalité de 90%, du moins dans les pays industrialisés (OMS, 2021).
Chaque pays peut avoir sa propre campagne de vaccination. Par exemple, le site web du Centre européen de lutte et de prévention des maladies (ECDC) contient des informations sur les programmes européens. Cependant, à l'heure actuelle, le vaccin triple contre la diphtérie, le tétanos et la coqueluche est le plus courant à la fois. Il est recueilli pendant l'enfance en trois doses. Selon les différentes évaluations mondiales, la couverture vaccinale de ce vaccin était de 81% en 2021, la plus faible depuis 2008 [35].
Comme nous l'avons dit, les vaccins reçus dans l'enfance sont généralement très légers. En outre, les vaccins des mères pendant la grossesse ont contribué à éviter l'hospitalisation et la mort des enfants. Dans ce cas, la mère passera les anticorps qu’elle aura pu créer à travers le placenta, donnant ainsi protection [23].
La toux fermentable est causée par la bactérie Bordetella pertussis et peut être contaminée par des sécrétions respiratoires ou des gouttes de salive. Jules Bordet et Octave Gengou ont été identifiés, isolés et semés pour la première fois en 1906 [4]. Grâce à cela et à d'autres découvertes liées à l'immunité, Bordet a reçu le prix Nobel de médecine et de physiologie en 1919.
Bien que la maladie soit connue depuis des années, nous ne pouvons pas la surmonter, car la quantité de contaminés augmente tous les 3-5 ans. Il s'agit aujourd'hui d'un problème de services de santé publics de différents pays. Ainsi, par exemple, toute l'Europe est en position de pilier depuis 2011 (ECDC), alors qu'à Osakidetza, il a annoncé une comparution en juin 2023 au Conseil consultatif.
Il est vrai que l’OMS s’est déclarée préoccupée depuis des années et a reconnu que l’augmentation de la maladie se produit à l’échelle mondiale. Contrairement à d'autres infections respiratoires, dans ce cas, les foyers ne sont pas uniformes, c'est-à-dire qu'ils ne sont pas associés à des endroits ou des stations spécifiques. Des études épidémiologiques indiquent que l’augmentation peut être associée à la perte d’immunité [22, 20, 34]. En d'autres termes, l'immunité au cumul est provisoire et a donc une date d'expiration. Selon les estimations, l'immunité naturelle dure jusqu'à l'âge de 3,5-30 ans, et celle acquise par les vaccins, de 4 à 14 ans. Par conséquent, une fois la maladie passée, il est très fréquent qu'elle soit à nouveau contaminée. Toutefois, la gravité des symptômes est liée au temps écoulé depuis l’obtention de l’immunité [46].
À travers les membranes cellulaires
B. pertussis a une affinité spécifique avec la muqueuse des voies respiratoires humaines. Cela signifie que vous avez la capacité de coller sur elle. Pour envahir et vivre les voies respiratoires haute et basse, il utilise différents facteurs de virulence. Certains vous aident à adhérer aux cellules hôtes, tandis que d'autres les utilisent pour rouler la couche épithéliale et éviter le système immunitaire. Si le lecteur souhaite en savoir plus sur ces facteurs de virulence, nous vous invitons à lire les révisions pertinentes [15, 9].
La liste des flacons utilisés par cette bactérie pour attaquer est longue. Parmi eux se trouve la toxine poreuse Adenilate Ciclasa, une protéine qui attaque les cellules du système immunitaire. Ainsi, il affaiblit les défenses humaines et la bactérie peut facilement se propager dans le corps [25, 7].
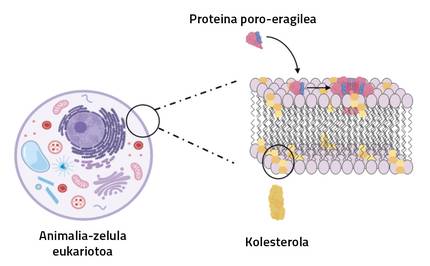
Les toxines responsables du pore (Pore-forming toxins) peuvent être décrites comme des perforatrices biologiques, car elles forment des canaux aqueux qui ornent la membrane d’un côté à l’autre [8, 30]. Les membranes biologiques sont un échafaudage solide et dynamique pour maintenir l'intégrité et l'architecture cellulaire. Ils sont composés de lipides, de protéines et de sucres, qui séparent le milieu interne et externe des cellules [45]. Ils régulent également ce qui peut entrer ou sortir de la cellule. Sa détérioration peut donc entraîner la mort de la cellule [3, 24, 47]. Dans tous les royaumes vitaux, nous pouvons trouver un organisme qui produit une toxine poreuse: bactéries pathogènes, nématodes, champignons, protozoaires parasites, grenouilles, plantes et organismes plus développés [19]. Cependant, les mécanismes moléculaires utilisés par toutes ces toxines pour attaquer les cellules sont similaires.
La toxine Adenilate Ciclasa, comme d'autres protéines responsables du pore, a une application spéciale. Au début, lorsque la bactérie produit et coule dans le milieu externe, elle est soluble dans l'eau et cache les régions hydrophobes. Au contraire, lorsque la cellule rencontre l'hôte, elle change d'aspect: elle montre ces régions protégées de l'eau et est insérée dans la membrane [8, 17, 32, 42]. Ensuite, plusieurs protéines sont réunies pour former le pore, formant une structure plus complexe. C’est ainsi que fonctionnent les cuisines, les cytokines, les hémolisines, la diphtérie toxine, l’antigène de protection de la toxine antrax ou les toxines poro-motrices de la famille Repeats in ToXins (RTX) [28]. La formation du pore elle-même est un processus très dynamique et donc difficile à observer. C'est un défi pour les chercheurs.
Lipides et protéines, quelle paire!
Les toxines portives, pour une insertion correcte dans la membrane cellulaire, sont généralement accompagnées de lipides à membrane. Les lipides peuvent ajuster directement ou indirectement le procédé. D'une part, ils peuvent interagir de manière spécifique avec les protéines [26, 36, 4o] et d'autre part, les caractéristiques biophysiques de la membrane (fluidité, séparation des phases, épaisseur, tension, etc.) peuvent moduler [10, 21, 39]. Ils peuvent donc modifier la structure et la fonction de la protéine.
Le cholestérol de la membrane, par exemple, contrôle l'activité de plusieurs récepteurs de membranes par des interactions spécifiques. Ils peuvent également contenir des protéines telles que des récepteurs de neurotransmetteurs et des convoyeurs ABC (ATP-Binding Casse) qui connaissent spécifiquement le cholestérol. Ces régions sont appelées CRAC (de l'anglais CholesterRecognition Amino acid Consensus) ou CARC inverse, et bien qu'elles aient des structures très diverses, elles utilisent des mécanismes similaires pour associer le cholestérol. Comme on peut le lire dans la littérature, certains acides aminés apparaissent souvent dans ces segments suivant un schéma déjà connu et décrit [14, 13].
De nombreux chercheurs se sont concentrés sur l'interaction lipides et protéines de la membrane. Il s'agit d'un sujet de grand intérêt qui réunit des disciplines scientifiques telles que la biochimie, la biophysique, la biologie cellulaire ou la bioinformatique. Au cours des dernières années, notre groupe a analysé l'interaction entre l'adénylate cyclaste toxine et la membrane, combinant principalement biophysique et biochimique. Nous avons récemment montré que l’activité toxique de la protéine dépend du cholestérol de la membrane [18] et qu’elle est une interaction spécifique entre la protéine et le cholestérol [1].
Pourquoi la recherche fondamentale?
L'être humain a appris à vivre avec la coqueluche et la situation s'est nettement améliorée depuis que les vaccins sont disponibles pour tous. Cela est certainement dû à la recherche fondamentale et au plan de recherche. L’identification, la description et la compréhension des instruments utilisés par la bactérie pour nuire aux êtres humains ont été essentielles pour expliquer les mécanismes moléculaires de la maladie et pouvoir agir contre le dôme.
Les toxines poreuses ont un caractère variable en fonction du milieu. Ils changent très rapidement, il est donc très difficile d'observer des processus aussi dynamiques. Cependant, ce ne sont pas des mécanismes isolés, mais ils sont également produits dans la nature en protéines du système immunitaire des vertébrés ou en protéines amyloïdes [27, 37]. Les efforts déployés pour comprendre ces protéines peuvent donc aider d’autres domaines.
Nous avons déjà dit que les toxines poreuses peuvent être vraiment nocives pour la santé humaine. Au contraire, ils ont été étudiés depuis longtemps et peuvent actuellement être utiles pour des applications biotechnologiques de grand avenir et de carrière: attaquer les cellules cancéreuses [31], tuer les bactéries pathogènes [5], les biocapteurs pour la détection [2]… Il a également été démontré que la toxine Adenilate Ciclasa peut être utilisée comme vaccin porteur [6]. Le développement de toutes ces applications a d'abord obligé à comprendre les normes physico-chimiques qui sont à l'origine de ces processus, ce qui nécessite une recherche fondamentale. En outre, la collaboration et la communication entre chercheurs multidisciplinaires faciliteront et accéléreront sans aucun doute la voie.
Bibliographie
- Amuategi, J., Alonso, R., et Ostolaza, H. 2022. “Four Cholester-Recognition Motifs in the Pore-Forming and Translocation Domains of Adenylate Cyclasse Toxin Are Essential for Invasion of Eukaryotic Cells and Lysis of Erythrocytes”. International Journal of Molecular Sciences, 23(15), Article 15. https://doi.org/10.3390/ijms23158703
- Anderluh, G., et Lakey, J. H. 2008 “Déclencheur proteins utilise similaire architectures to damage membranes”. Trends in Biochemical Sciences, 33(10), 482-490. https://doi.org/10.1016/j.tibs.2008.07.004
- Bernardes, N., et M. Fialho, A. 2018 “Perturbing the Dynamics and Organization of Cell Membrane Components: A New Paradigm for Cancer-Target Therapies ». International Journal of Molecular Sciences, 19(12), 3871. https://doi.org/10.3390/ijms19123871
- Bordet J, Gégou O. 1906. « Le microbe du coqueluche. Ann Inst Pasteur (Paris). 1906;20:731–41
- Brogden, K. A. 2005 “Antimicrobial peptides: Pore formers or metabolic inhibiteurs in bacteria?” Nature Reviews Microbiology, 3(3), 238–250. https://doi.org/10.1038/nrmicro1098
- Carneiro, G. B. Castro, J. T., Davi, M., Miyaji, E. N., Ladant, D., et Oliveira, M. L. S. 2023. “Inmune responses and protection against Streptococcus pneumoniae elicited by recombinant Bordetella pertussis adenylate cyclasse (CyaA) carrying fragments of pneumococcal surface protein A, PspA”. Vaccine. https://doi.org/10.1016/j.vaccine.2023.05.031
- Chenal, A. 2018 Introduction to the Toxins Special Issue on the Adenylate Cyclasse Toxin. Toxins, 10, 386.
- Da Peraro, M., et van der Goot, F. G. 2016 Pore-forming toxins: Ancient, but never really out of fashion. Nature Reviews Microbiology, 14(2), Article 2. https://doi.org/10.1038/nrmicro.2015.3
- Dorji, D., Mooi, F., Yantour, O., Deora, R., Graham, R. M., et Mukkur, T. C. (2018). Bordetella Pertussis virulence factors in the continuing evolution of whooping cough vaccines for improved performance. Medical Microbiology and Immunology, 207(1), 3-26. https://doi.org/10.1007/s00430-017-0524-z
- Escribá, P. V. Gonzalez-Ros, J. M. Goñi, F. M. Kinnunen, P. C. J. Vigh, L., Sánchez-Magraner, L. Fernández, A. M. Busquets, X. Horváth, I., et Barceló-Coblijn, G. (2008). Membranes: A meeting point for lipids, proteins and therapies. Journal of Cellular and Molecular Medicine, 12(3), 829-875. https://doi.org/10.1111/j.1582-4934.2008.00281.x
- Ethymologie: Bordetella pertussis. (2010). Emerging Infectious Diseases, 16(8), 1278. https://doi.org/10.3201/eid1608.ET1608
- European Center for Disease Prevention and Control: Pertussis (whooping cough) https://www.ecdc.europa.eu/en/pertussis-whooping-cough 2023-06-19
- Fantini, J., et Barrantes, F. J. (2013). How cholesters interacts with membrane proteins: An exploration of cholvol-binding sites including CRAC, CARC, and tilted domains. Frontiers in Physiology, 4, 31. https://doi.org/10.3389/fphys.2013.00031
- Fantini, J., Di Scala, C., Evans, L. S. Williamson, P. T. F. et Barrantes, F. J. (2016). A mirror code for protein-cholester-interactions in the two leaflets of biological membranes. Scientific Reports, 6(1), Art. 1 https://doi.org/10.1038/srep21907
- Fedele, G., Bianco, M., et Ausiello, C. M. (2013). The virulence factors of Bordetella pertussis: Talented modulators of host immune response. Archivum Immunologiae Et Therapiae Experimlis, 61(6), 445-457. https://doi.org/10.1007/s00005-013-0242-1
- Fry, N. C., Campbell, H., et Amirthalingam, G. (2021). JMM Profile: Bordetella pertussis and whooping cough (pertussis): still a significant cause of morbidity and mortality, but vaccine-preventable. Journal of Medical Microbiology, 70(10), 001442. https://doi.org/10.1099/jmm.0.001442
- Gilbert, R. J. C. Dalla Serra, M., Froelich, C. J. Wallace, M. I, et Anderluh, G. (2014). Membrane pore formation at protein-lipid interfaces. Trends in Biochemical Sciences, 39(11), 510-516 https://doi.org/10.1016/j.tibs.2014.09.002
- González Bullón, D. Uribe, C. B. Amuategi, J., Martin, C., et Ostolaza, H. (2021). Cholesters stimulates the lytic activity of Adenylate Cyclasse Toxin on lipid membranes by promoting toxin oligomerization and formation of pores with a grand effective size. The FEBS Journal, 288(23), 6795-6814. https://doi.org/10.1111/febs.16107
- Gupta, L. C., Molla, J., et Prabhu, A. A. (2023). Story of Pore-Forming Proteins from Deadly Disease-Causing Agents to Modern Applications with Evolution Significance. Moléculaire Biotechnology. https://doi.org/10.1007/s12033-023-00776-1
- Gustafsson L, Hessel L, Storsaeter J, Olin P. Long-term follow-up of Swedish children vaccinated with acellular pertussis vaccines at 3, 5 and 12 months of age indicates the need for a booster do 5 to 7 years of age. Pediatrics. 2006 Sep;118(3):134.ajuste: 10.1542/peds.2005-2746. PMID: 16950988.
- Janmey, P. A., et à Kinnun, P. C. J. (2006). Biophysical properties of lipids and dynamic membranes. Trends in Cell Biology, 16(10), 538-546. https://doi.org/10.1016/j.tcb.2006.08.009
- Jenkinson D. Duration of effectiveness of pertussis vaccine: evidence from 10 year community study. BMJ 1988; 296:612–614.
- Kilgore, P. R. Salim, A. M. Zervos, M. J., et Schmitt, H.-J. (2016). Perussis: Microbiology, Disease, Treatment, and Prevention. Clinical Microbiology Reviews, 29(3), 449-486. https://doi.org/10.1128/CMR.00083-15
- Kulma, M., et Anderluh, G. (2021). Beyond pore formation: Reorganization of the plasma membrane induced by pore-forming proteins. Cellular and Molecular Life Sciences, 78(17), 6229-6249. https://doi.org/10.1007/s00018-021-03914-7
- Ladant, D., et Ullmann, A. (1999). Bordetella pertussis adenylate cyclasse: Avec de multiples talents. Trends in Microbiology, 7(4), 172-176. https://doi.org/10.1016/s0966-842x(99)01468-7
- Laganowsky, A., Reading, E., Allison, T. M. Ulmschneider, M. B. Degiacomi, M. T., Baldwin, A. J. et Robinson, C. V. (2014). Membrane proteins bind lipids selectively to modulate their structure and function. Nature, 510(7503), 172-175 https://doi.org/10.1038/nature13419
- Lashuel, H. A. et Lansbury, P. T. (2006). Même amyloid diseases caused by protein aggregates that mimic bactérien pore-forming toxins? Quarterly Reviews of Biophysics, 39(2), 167-201. https://doi.org/10.1017/S0033583506004422
- Boîte, C., Singh, M., Chatterjee, S., et Chattopadhyay, K. (2022). Membrane Dynamics and Remodelling in Response to the Action of the Membrane-Damaging Pore-Forming Toxins. The Journal of Membrane Biology, 255(2-3), 161-173. https://doi.org/10.1007/s00232-022-00227-z
- Lukšiic, I., Kearns, P. C., Scott, F., Rudan, I. Campbell, H., et Nair, H. (2013). Viral etiology of hospitalized acute lower respiratory infections in children under 5 years of age—A systematic review and meta-analysis. Croatian Medical Journal, 54(2), 122-134. https://doi.org/10.3325/cmj.2013.54.122
- >Mondal, A. K., et Chattopadhyay, K. (2020). Taking Toll on Membranes: Curious Cases of Bacteria β-Barrel Pore-Forming Toxins. Biochemistry, 59(2), 163-170. https://doi.org/10.1021/acs.biochem.9b00783
- Pahle J, Aumann J, Kobelt D, Walther W (2015) Oncoleaking: use of the pore-forming clostridium perfringens enterotoxin (CPE) for suicide gene therapy. Methods Mol Biol 1317:69–85. justiprix:10.1007/10001-4939-27-25-5
- Parker, M. W., et Feil, S. C. (2005). Pore-forming protein toxins: From structure to function.Progress in Biophysics and Molecular Biology, 88(1), 91-142. https://doi.org/10.1016/j.pbiomolbio.2004.01.009
- Pertussis, WHO: https://www.who.int/health-topics/pertussis#tab=tab_1 (19-06-2023)
- Quinn HE et al. Pertussis épidéiology in Australia over the decade 1995-2005 –trends by region and age group. Communicable Diseases Intelligence, 2007, 31:205–215.
- Rachlin, A., Danovaro-Holliday, M. C. Murphy, P., Sodha, S. V, et Wallace, A. S. (2022). Routine Vaccination Coverage—Worldwide, 2021.
- Renard, K., et Byrne, Morbidity and Mortality Weekly Report, 71(44), 1396-1400. https://doi.org/10.15585/mmwr.mm7144a2B. (2021). Insights into the Role of Membrane Lipids in the Structure, Function and Regulation of Integral Membrane Proteins. International Journal of Molecular Sciences, 22(16), Art. 16 https://doi.org/10.3390/ijms22169026
- Filetage, C. J. et al. (2007). A common fold mediates defense and bacter attack. Science, 317(5844), 1548-1551. https://doi.org/10.1126/science.1144706
- Safiri, S., Mahmoodpoor, A., Kolahi, A. Nejadghaderi, S. A. Sullman, M. J. M. Mansournia, M. A. Ansarin, K., Collins, G. S. Kaufman, J. S., et Abdollahi, M. (2023). Global burden of lower respiratory infections during the last three decades.Frontiers in Public Health, 10, 1028525. https://doi.org/10.3389/fpubh.2022.1028525
- Salle - Estrada, L. A. Leioa, N., Romo, T. D., et Grossfield, A. (2018). Lipids Alter Rhodopsin Function via Ligand-like and Solvent-like Interactions.Biophysical Journal, 114(2), 355-367. https://doi.org/10.1016/j.bpj.2017.11.021
- Sych, T., Levental, K. R., et Sezgin, E. (2022). Lipid-Protein Interactions in Plasma Membrane Organization and Function. Annual Review of Biophysics, 51, 135-156. https://doi.org/10.1146/annurev-biophys-090721-072718
- Surveillance Atlas of Infectious Diseases (ECDC): https://atlas.ecdc.europa.eu/public/index.aspx?Dataset=27etaHealthTopic=38 (2023-06-20)
- Tilley, S. J. et Saibil, H. R. (2006). Le mechanism of pore formation by bactérienne toxins. Current Opinion in Structural Biology, 16(2), 230-236. https://doi.org/10.1016/j.sbi.2006.03.008
- Troeger et al. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory tract infections in 195 countries: A systematic analysis for the Global Burden of Disease Study 2015. (2017). The Lancet. Infectious Diseases, 17(11), 1133-1161 https://doi.org/10.1016/S1473-3099(17)30396-1
- Vaccine Scheduler (ECDC). Pertussis recommended vaccinations: https://vaccine-schedule.ecdc.europa.eu/Scheduler/ByDisease?SelectedDiseaseId=3etaSelectedCountryIdByDisease=-1 (2023-06-20)
- Watson H. “Biological membranes”. 2015Essays Biochem. 2015;59:43-69 Aj. :10.1042/bse0590043 PMID: 26504250; PMCID: PMC4626904.
- Wearing, H.J. et Rohani, P. 2009 “Estimating the duration of pertussis immunty using épidéiological signatures”. PLoS Patastilla. 5(10), e1000647.
- Zhang, Y. Chen, X., Gueydan, C., et Han, J. 2018 “Plasma membrane changes during programmed cell deaths”. Cell Research, 28(1), Art. 1 https://doi.org/10.1038/cr.2017.133.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia