Méthane: Juste source d'énergie?
2013/02/01 Lakuntza Irigoien, Oier - Kimikan doktoreaKimika Teorikoko Laborategia Iturria: Elhuyar aldizkaria

L'activation de la liaison C-H du méthane au niveau industriel, dans des conditions agiles de réaction, est l'un des défis les plus importants de la chimie actuelle. En fait, si cette activation était possible, le méthane serait l'un des composés chimiques les plus utilisés, non seulement dans la production d'énergie, mais dans l'obtention d'hydrogène moléculaire et dans la synthèse de composés chimiques plus précieux comme les alcools ou les hydrocarbures plus grands.
En général, quand on parle d'activation des eaux saturées, formées par des liens C-C et C-H, on parle de casser de façon contrôlée l'un de ses liens C-C ou C-H. C'est le premier obstacle à surmonter dans de nombreuses utilisations de ces composés. Ces processus, cependant, sont très coûteux du point de vue énergétique dans des conditions de réaction conventionnelles, limitant l'utilisation actuelle des eaux saturées à la production énergétique par combustion principalement. Cette utilisation exploite la capacité énergétique de ces composés, mais pas la possibilité d'obtenir des composés plus utiles et précieux à partir de ce composé.
Dans la mesure où le méthane, CH 4, est le plus petit des eaux saturées, on peut dire que son activation a certaines particularités. D'une part, dans la mesure où les quatre hydrogènes du méthane sont équivalents, leur activation ne comporte pas de problèmes de sélectivité habituels dans ces cas, puisque le produit sera le même. D'autre part, les liaisons C-H étant les plus fortes dans les canalisations des carbures des coins, il est clair que le méthane est un cas extrême.
De même, pour comprendre l'importance de l'activation de ce composé, principal composant du gaz naturel, il convient de tenir compte de son origine. En fait, le méthane apparaît comme un produit de décomposition anaérobie de la matière organique et du métabolisme des micro-organismes méthanogéniques, de sorte qu'il existe dans le monde de grandes réserves naturelles de méthane, estimant que la quantité mondiale de méthane est le double des déchets fossiles.
Une grande partie de ces réserves naturelles sont concentrées dans les océans et les lacs comme les hydrates de méthane. Ainsi, le méthane est souvent connu comme le gaz des lacs. Ces hydrates de méthane sont des clatrates de méthane formés dans des conditions à basse température et à haute pression, structures ouvertes formées par des molécules d'eau qui abritent une molécule de méthane.
On estime que plus de la moitié du méthane et du gaz naturel sont à l'état méthano-hydrate au niveau mondial. Ainsi, de nombreux pays étudient et étudient la possibilité d'utiliser cet hydrate de méthane comme combustible.
En plus des sols des océans et des lacs, dans les premières couches de la croûte terrestre, il existe de grandes réserves de méthane adsorbées dans les veines de charbon. Ainsi, ce méthane est utilisé dans de nombreux pays pour réduire la dépendance au pétrole. Cependant, l'utilisation de ce méthane comporte également des risques. C'est parce qu'il est nécessaire d'utiliser de grandes quantités d'eau pour réduire la pression et libérer le gaz des pores. Ceci, en plus de réduire les niveaux d'eau des aquifères, peut entraîner une contamination de l'eau.
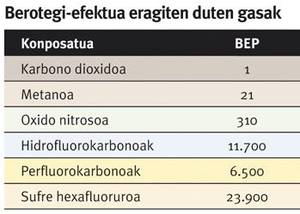
En plus des deux risques mentionnés, il existe actuellement un autre qui a acquis une grande attention. En fait, l'effet de serre potentiel du méthane (PIR) est 21 fois supérieur à celui du dioxyde de carbone. Par conséquent, dans l'exploitation des différents types de provisions naturelles de méthane, il est nécessaire d'adopter des mesures pour éviter la fuite de gaz dans l'atmosphère, ce qui pourrait augmenter le changement climatique.
En ce sens, dans de nombreuses zones d'élevage, de décharges et d'épuration à forte production de méthane, au lieu de libérer le méthane généré, est recueilli et utilisé dans la production d'énergie. De cette façon, cependant, le dioxyde de carbone est généré, principal responsable du changement climatique malgré un PIR inférieur au méthane. L'activation du méthane peut être la clé pour résoudre ce problème.
L'effet de serre potentiel (PEP) reflète la capacité d'un gaz à provoquer l'effet de serre. Il est utilisé comme référence le dioxyde de carbone, et la valeur PIR d'un gaz indique le nombre de fois qu'une certaine concentration maintient la chaleur du soleil dans l'atmosphère au-dessus de la même concentration de dioxyde de carbone.
Recherche des catalyseurs les mieux adaptés
En revenant à l'activation du méthane, pour réduire les besoins énergétiques associés à la rupture de sa liaison C-H, des catalyseurs sont utilisés en laboratoire. En fait, la plupart des recherches actuelles utilisent des composés de métaux de transition qui apparaissent dans le bloc central du tableau périodique. Nous disons des composés parce que les métaux de transition peuvent être utilisés de différentes formes: comme des atomes neutres, comme des cations, comme des clusters ou comme structures de plusieurs atomes de métal, ou comme des atomes de métal attachés à d'autres éléments non métalliques. Précisément, sur le chemin de l'activation du méthane industriel, la clé est de trouver le catalyseur le plus approprié.
Les métaux de transition ont généralement d'autres structures possibles proches de la structure ou de l'état électronique de leur niveau énergétique le plus bas, à savoir la façon de distribuer les électrons à travers la molécule, et lors de la recherche de l'activation du méthane avec ces catalyseurs, il est nécessaire de tenir compte de ces situations. C'est parce que, même si une situation électronique est à un niveau d'énergie supérieur à l'autre, il peut avoir une stabilité suffisante et que dans ce cas la réaction se produit.
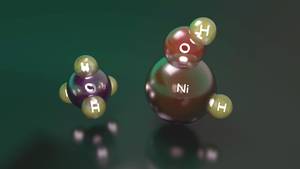
Un exemple clair en est la réaction entre le nickel hydroxyde hydride et le méthane. En effet, bien que ce composé puisse activer le méthane, quand il se trouve dans son état le plus bas d'énergie, il semble un complexe entre le nickel cation et l'eau qui n'a pas la capacité de l'activer. Au contraire, lorsque le niveau énergétique est plus élevé, la quantité d'énergie nécessaire à l'hydrogène pour passer du nickel à l'oxygène est plus élevée, il a donc une stabilité suffisante pour activer le méthane avant de fournir un complexe inréactif entre le nickel cation et l'eau.
Bien que le réactif de ce deuxième état ait un niveau d'énergie supérieur à celui du premier état, il est capable de le maintenir dans cet état électronique. Cependant, en arrivant à un intermédiaire de la voie de réaction, les deux situations deviennent interchangeables et, en passant de la situation initiale à la stable, un complexe se produit entre le cation de nickel et l'eau, terminant la réaction. Ainsi, bien que le nickel hydroxyde hydride cationique est capable d'activer le méthane, il obtient une très faible performance de réaction, à savoir des réactifs qui déclenchent la réaction que quelques-uns obtiennent d'activer le méthane.
Comme nous descendons dans le tableau périodique, la stabilité de l'état d'énergie le plus bas augmente. Dans cette situation, dans le cas du platine qui est le plus grand atome du groupe nickel, on peut penser que les platines hydroxyde et sulfhydride cations (HP tOH+ et HP tSH+) peuvent réagir avec le méthane, car il a été démontré qu'ils sont suffisamment stables dans leur état fondamental.
Compte tenu de l'exemple du cationon nickel hydroxyde hydride, et étant possible l'activation du méthane dans la situation la plus basse de l'énergie, on estime qu'il augmente la probabilité d'obtenir des rendements de réaction plus élevés. En fait, dans ce cas, il n'est pas possible de passer à un état où le système présente un niveau d'énergie inférieur et ne présente pas de stabilité suffisante pour réagir avec le méthane.
Pour s'assurer que ces composés de platine activent le méthane, il faudrait étudier cette réaction par lui-même, car il est possible que ces deux catalyseurs ne soient pas suffisants pour activer le méthane. Bien que cette étude n'ait pas encore été réalisée, il est connu que le cationon de platine active le méthane dans des conditions de réaction légères, et il a été observé que l'ajout à un métal de transition de groupes d'hydride (-H), hydroxyde (-OH) ou sulfhydride (-SH) augmente la réactivité du métal par rapport au méthane. Par conséquent, ces composés peuvent être adaptés pour continuer à étudier.
Pour terminer, nous allons jeter des exemples concrets et revenir au problème du changement climatique. Dans les réactions entre ces métaux de transition composites et le méthane est souvent libéré hydrogène moléculaire. Ainsi, comme mentionné précédemment, si l'activation du méthane était possible, le méthane pourrait être utilisé comme source de H2, et comme il s'agit d'un combustible qui ne génère pas de dioxyde de carbone, cela permettrait d'obtenir un combustible "propre" à partir d'un composé avec un fort potentiel d'effet de serre.
Bibliographie Bibliographie

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia