Priones, guardián de la memoria
2017/03/01 Agirre Ruiz de Arkaute, Aitziber - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
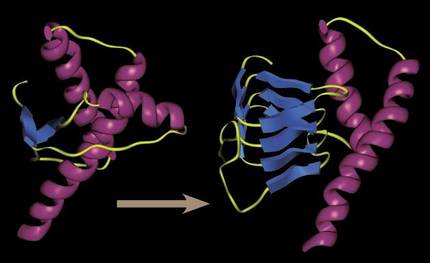
Hace 30 años era inimaginable hablar de un sistema orgánico infeccioso capaz de “reproducirse” sin ADN o ARN. Todos los sistemas infecciosos tenían estructuras genéticas para aumentar la infección y la proliferación de virus, los agentes infecciosos más simples aún conocidos. Pero los priones demostraron que era posible: unas proteínas simples plegadas equivocadamente eran capaces de contagiar a las proteínas del entorno su plegado incorrecto. Por contacto, sin necesidad de reproducirse.
Conseguían alterar la forma tridimensional de las proteínas funcionales que les acompañaban, y al tratarse de una forma tridimensional generada de carácter desengordable, los priones tendían a congregarse creando agregados cada vez más grandes y dificultando los procesos celulares.
Las enfermedades provocadas por los priones dispararon alarma desde el principio, en la crisis de las vacas locas, cuando la comunidad científica quedó sin palabras ante esta nueva forma de infección. El mero hecho de ser priones era emocionante desde el punto de vista biológico, no se podía negar, pero al mismo tiempo era terrorífico. No sabían por dónde abordar las infecciones provocadas por los priones. Además, se ha observado que pueden estar en la base de muchas enfermedades neurodegenerativas, como el alzheimer y el parkinson.
Sin embargo, después de muchos estudios, la cara amable de los priones ha empezado a emerger: priones no patógenas, creadoras de agregados y con tareas específicas en nuestro cuerpo.
Memoria a largo plazo a manos de los priones
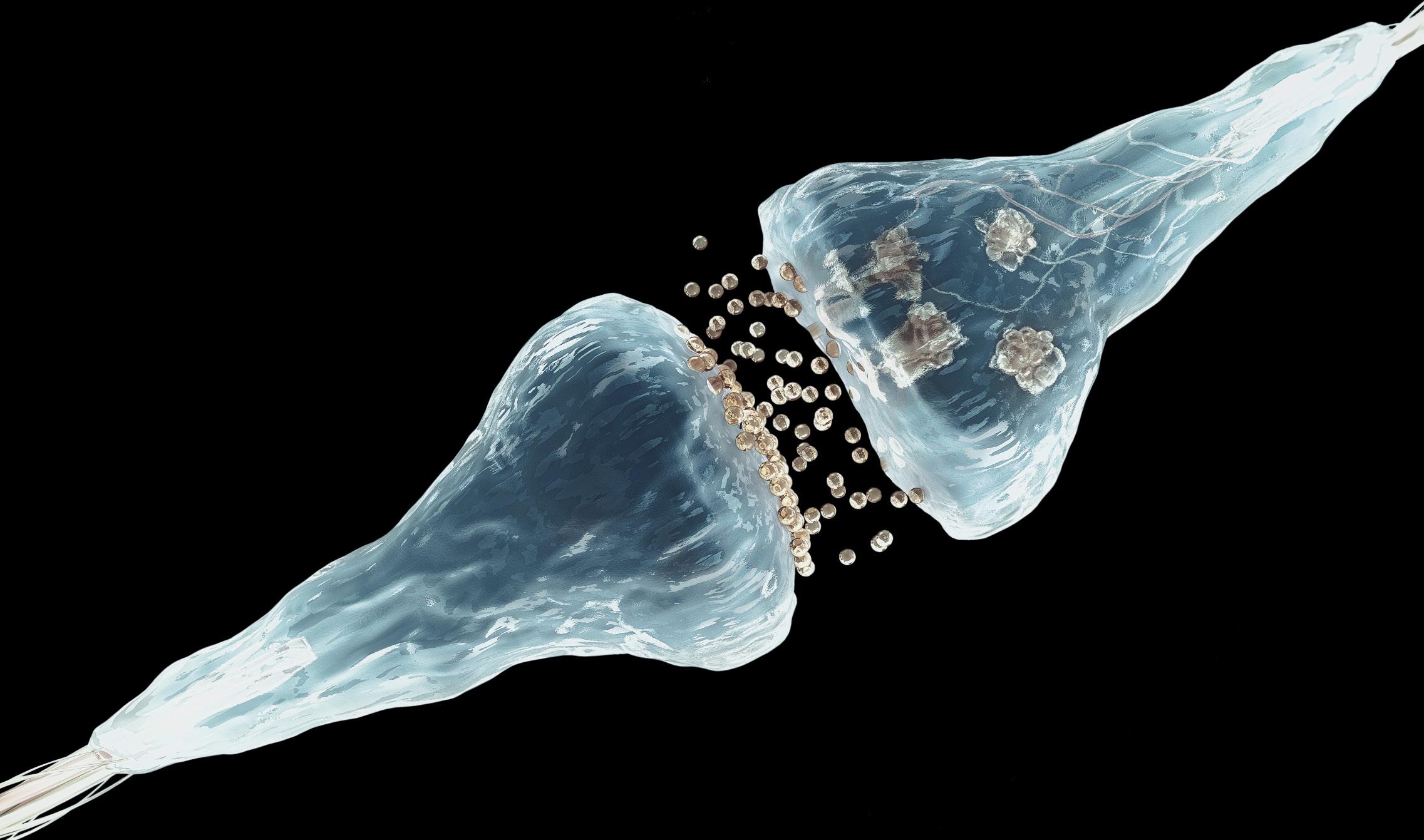
Si nos fijamos en el cerebro, veremos mil millones de neuronas, cada una con muchas sinapsis. En estas sinapsis se fija la memoria, gracias a ellas guardamos químicamente los recuerdos. Francis Crick, uno de los descubridores de la estructura del ADN, sin embargo, expresó hace 20 años una preocupación: ¿cómo es posible que los recuerdos permanezcan mucho más tiempo de lo que las proteínas permanecen en las células vivas? Si las proteínas de las sinapsis duran dos meses, ¿cómo se puede mantener químicamente un recuerdo durante años? ¿Cómo se puede estabilizar una sinapsis para siempre?
Crick previó la presencia de una proteína que se agrega de alguna manera en este proceso. Al ser agregado, no tendría capacidad de movimiento, y eso podría ser la manera de estabilizar una determinada sinapsis.
Después vieron que en las sinapsis aparecían priones y comenzaron a experimentar para entrenar a los ratones para que atravesaran un laberinto una y otra vez, hasta que esa experiencia se consolide como un recuerdo a largo plazo. A través de la ingeniería genética, silenciaron el gen del prión CPEB, típico de las simapsis neuronales, y los resultados fueron sorprendentes: dos semanas después de la consolidación del recuerdo ya había desaparecido.
Lo mismo han visto en las moscas de vinagre. Si una hembra no muestra una posición de cópula respecto a un macho determinado, ese macho lo recordará y no volverá a intentarlo, aunque haya pasado mucho tiempo. Al mutar la proteína Orb2 que actúa como prión, a partir de un solo día, los recuerdos se vuelven inestables; pasados tres días, han desaparecido completamente. El macho intentará de nuevo cubrirla.
A partir de ahí han visto que los priones sirven para fortalecer y estabilizar las sinapsis neuronales, lo que permite mantener la memoria a largo plazo. Los priones parecen ideales para este trabajo. De hecho, crean estructuras poliméricas muy estables en el tiempo y además su conversión es autosuficiente: cuando un prión cambia su plegado, las proteínas circundantes seguirán cambiando automáticamente su plegado. Este proceso por contagio de priones resuelve el problema de Crick, ya que, más allá del estímulo inicial de la neurona, continuarán creando cadenas agregadas sin más estímulos. Esto mantendrá constantemente la sinapsis y, por tanto, el recuerdo.
Pero no guardamos todos los recuerdos para siempre. La neurona, con una regulación estricta, separa los circuitos neuronales estabilizados y cuales no. Cuando recibe el pulso eléctrico, en una compleja danza bioquímica que sólo se produce en esa sinapsis, activa el cambio de plegado y la activación del prión con la colocación de un grupo de fosfatos. A partir de ahí, mientras se mantengan los agregados del prión, se mantendrán recuerdos a largo plazo. Ellos son la base bioquímica de la memoria.

Eso sí, su propia responsabilidad como sistema de memoria convierte a los priones en agentes patógenos de las neuronas y de la memoria. Así podría entenderse su implicación en las enfermedades de Alzheimer y Parkinson.
Floración de plantas
Los mamíferos no somos los únicos que aprovechamos el trabajo de los priones. Por ejemplo, los genéticos del Massachusetts Institute of Technology (MIT) han encontrado en las plantas alrededor de 500 proteínas con características de priones. Muchos de ellos tienen funciones relacionadas con el logro.
Las plantas desarrollan la memoria para dar respuesta a las condiciones del entorno. Registran de alguna manera sequías, calentamientos, enfriamientos y agentes patógenos sufridos anteriormente. La memoria de la hibernación, por ejemplo, se desarrolla después de sentir el frío durante mucho tiempo. Gracias a esta memoria, las plantas recuerdan los inviernos que han pasado y regulan el momento de la floración. Según los investigadores del MIT, los priones son esenciales para registrar a largo plazo las condiciones del entorno y regular el proceso de floración de los futuros. De alguna manera, en la descendencia también ayudan a conservar la memoria del frío, de generación en generación, sin necesidad de implicar a los genes. Gracias a ellos, las plantas que aún no han sufrido frío tienen esta memoria. Según los investigadores del MIT, los priones han proporcionado la clave para entender la memoria molecular basada en proteínas.
También las bacterias
Hasta ahora, las bacterias eran las únicas que no mostraron signos de priones entre los seres vivos, pero los últimos estudios han demostrado que también las bacterias las tienen. Se han analizado 60.000 genomas bacterianos en busca de secuencias genéticas similares a los priones de las levaduras y han visto que una secuencia de proteína llamada Rho podía ser un buen candidato. Así, se ha comprobado que la proteína Rho de la bacteria Clostridium bolutilum se inyecta en la bacteria Escherichia coli y se comporta como los priones.
El Rho es un componente que regula la expresión y la actividad de muchos genes. Al inyectar la versión normal de la proteína Rho vieron que silenciaba la actividad genética de Escherichia coli y que al inyectar la versión priónica muchos genes se activaban. A la vista de ello, los investigadores creen que en el caso de las bacterias, mediante la regulación de los genes, los priones pueden ayudar a adaptarse a los cambios bruscos de las condiciones ambientales. Esto permitiría dar una respuesta rápida ante cambios de condiciones, como la presencia de un antibiótico.
Además, dado que los priones son hereditarios, cabe pensar que permitirán que las bacterias heredan estas características sin necesidad de mutaciones genéticas.
Por su presencia en las bacterias, los priones parecen estar mucho más extendidos en la naturaleza de lo que se pensaba, y aparecieron antes de que surgieran los eucariotas, hace más de 2.300 millones de años. ¿Pero de dónde vienen esas misteriosas proteínas?
Los priones nunca han sido de los que pasan desapercibidos. Están acostumbrados a dar sorpresas. Sin embargo, no sabemos qué otras capacidades les van a dar su carácter especial. Los investigadores aseguran que ya han empezado a entenderlos y que van a traer casi necesariamente más sorpresas.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia