Carrera de barreras de medicamentos
2002/12/01 Galarraga Aiestaran, Ana - Elhuyar Zientzia Iturria: Elhuyar aldizkaria
El hombre siempre ha buscado sustancias que curan o alivian las enfermedades. En un principio se obtenían principalmente de plantas y animales, pero desde la Segunda Guerra Mundial, la síntesis química y la biotecnología han ayudado a la mayoría de los nuevos medicamentos. En la
obtención y comercialización de un nuevo medicamento intervienen especialistas en áreas tan diversas como la química, la biología molecular, la farmacia básica y clínica, la economía y la estadística. A la labor intelectual hay que añadir el dinero, ya que se sabe que las industrias farmacéuticas obtienen enormes beneficios gracias a una serie de prestigiosos medicamentos, pero también es cierto que las investigaciones son costosas y duran muchos años. Cuando se comercializa un medicamento pueden pasar entre 10 y 15 años y la investigación puede costar entre decenas y cientos de millones de euros.
Búsqueda de la molécula motriz
La búsqueda de un nuevo medicamento comienza con la búsqueda de posibles componentes activos. El componente activo es el corazón del fármaco, con efectos farmacológicos. Antes, la mayoría se obtenían de las plantas: al ver que los efectos de una planta sobre los animales y sobre los seres humanos eran favorables, se concluía que servía para curarla. Posteriormente, se intentó identificar y aislar el componente activo de las plantas utilizadas tradicionalmente en medicina, con el fin de sintetizarlo en el laboratorio.
Paralelamente, se empezaron a realizar y probar nuevas moléculas con potencial curativo, pero la búsqueda era ciega, no estaba basada en el método científico.
En la actualidad, la búsqueda se basa en el conocimiento de los mecanismos de la enfermedad. Sabiendo que la enfermedad provoca cambios bioquímicos y celulares, los investigadores tratan de buscar las sustancias que afrontan estos cambios. Se trata de identificar el receptor y sintetizar la molécula que lo une. De esta forma, al asociar esta molécula al receptor, se consigue aumentar o inhibir la actividad que la célula tendría de por sí misma.
En otras ocasiones, el objetivo es mejorar una molécula que ya se conoce y para ello se ponen a prueba los cambios estructurales; en ocasiones, basta con modificar ligeramente la estructura para aumentar considerablemente la eficiencia o convertirla en apta para otro uso.
También puede ocurrir que encontremos aleatoriamente el componente activo de un medicamento nuevo. Así ocurrió, por ejemplo, con la penicilina. La historia es conocida: Mientras Alexander Fleming trabajaba con el virus de la gripe, descubrió que en algunas culturas bacterianas algo impedía la proliferación de la bacteria Staphylococcus, una cultura bacteriana que estaba enlucida y que el culpable era una sustancia del moho. Y así descubrió la penicilina, el antibiótico más utilizado durante muchos años.
Claudio Palomo, catedrático de la Facultad de Química de la UPV/EHU en Donostia, considera que el instinto tiene una gran importancia en la búsqueda de nuevos fármacos. De hecho, en la sección de Química Orgánica se está probando una molécula hallada al azar; aunque la investigación se encuentra en las primeras fases, los resultados son muy satisfactorios.
Sin embargo, no todo se puede atribuir al azar; el descubrimiento de Fleming tuvo lugar en 1928, pero tanto en 1875 como en 1925 otros investigadores que escribieron que el moho tenía un efecto antibacteriano, pero no fueron capaces de profundizar más. Así que para encontrar un nuevo medicamento, la suerte no es suficiente.
Primeras pruebas

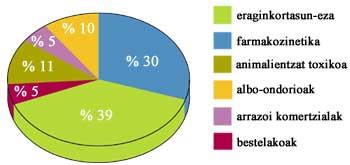
En todos los casos, el siguiente paso es sintetizar unos gramos. Con ellos se realizan las primeras pruebas de la molécula candidata. A menudo las moléculas son muy efectivas en los ensayos, pero muy pocas superan las pruebas previas al inicio de los ensayos clínicos y, por supuesto, son menos las que llegan al final. Según datos de EE.UU., de los 5.000 compuestos que comienzan a estudiarse en el laboratorio, sólo cinco llegan a probarlo en humanos. Y sólo uno de estos cinco es lo suficientemente eficaz y seguro como para acceder a la clínica médica.
El objetivo de las primeras pruebas es conocer en detalle las características del componente activo: características físico-químicas, estabilidad, solubilidad, etc. Además, se analiza in vitro la influencia del componente mediante sistemas no celulares (en preparados enzimáticos) y cultivos celulares animales o humanos.
Primeros pasos en la Facultad de Química de San Sebastián de la UPV

En Euskal Herria, la universidad, el hospital y el laboratorio trabajan juntos para conseguir nuevos medicamentos. El departamento de Química Orgánica de la Facultad de Química de la UPV/EHU es uno de los participantes en este trabajo. Es aquí donde se da el primer paso, es decir, se buscan nuevos componentes activos.
Tienen varias vías de búsqueda. Hace unos años desarrollaron una metodología propia de creación de péptidos. Los péptidos son moléculas formadas por 3-4 aminoácidos que, aunque pequeños, pueden influir. Ahora mismo se está estudiando uno de estos péptidos. Según el profesor Iñaki Gamboa, el proceso no es nada fácil, pero se cree que si sale bien es un paso importante.
Farmacológico a medicamento
Para avanzar hay que dar otro paso importante: hacer el medicamento con el fármaco. Normalmente se consideran sinónimos el fármaco y el medicamento, pero según explica José Luis Pedraz, catedrático de la Facultad de Farmacia de la UPV/EHU en Vitoria-Gasteiz, no son lo mismo: el fármaco es una molécula de efecto farmacológico que el preparado para curar.

La labor de los farmacéuticos consiste en la elaboración de un preparado con el que se puedan administrar pacientes. El preparado, además de poder ser ingerido por una u otra vía, debe cumplir otras características como ser estable, desprender el componente activo tras su administración y ser capaz de accionar. Todo esto no es nada fácil y puede que tenga que prescindir de una molécula candidata efectiva porque no se puede preparar el medicamento. Pedrat cree que uno de los desafíos de la farmacología actual es que los genes o fragmentos de ADN y moléculas potentes, sean capaces de convertirse en medicamentos. Y es que, aunque pueden ser muy útiles para curar enfermedades, todavía no es posible tomarlas como otros medicamentos.
Cuando se consigue preparar el medicamento con la molécula motriz, comienzan las pruebas de toxicidad en los animales. Las primeras sesiones se realizan con el ratón, por un lado porque al ser pequeñas no son necesarias grandes cantidades y por otro, porque existen procedimientos regulados en el ratón para medir la toxicidad. Posteriormente se realizan pruebas con animales de mayor tamaño.
En estas sesiones se analiza el intervalo entre la dosis letal y la efectiva; cuanto mayor es el intervalo, más seguro es el medicamento. Además, se observan los efectos adversos que se manifiestan, tanto de forma inmediata como a largo plazo, como en generaciones futuras
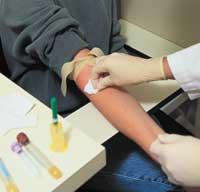
Midiendo la seguridad del fármaco en el ser humano
Cuando los resultados de todas las pruebas anteriores son satisfactorios, hay que ver qué efecto tiene el medicamento en el ser humano. Para ello se realizan sesiones clínicas y se analizan los efectos terapéuticos y los efectos adversos. En función de los resultados, se determina si sirve o no para la terapia y, si es válido, se determinan las dosis y la posología (cuándo y en cuántos).
Las sesiones clínicas se dividen en cuatro fases en función de los objetivos. Los objetivos principales de estas cuatro fases son, respectivamente, el análisis de la seguridad, la medición de la eficiencia, la comparación con otros medicamentos y el seguimiento y profundización en las investigaciones una vez comercializadas.
En una primera fase, por tanto, se debe demostrar que el medicamento es seguro. La importancia de esta fase es enorme, ya que hasta entonces esta sustancia nunca ha sido probada en humanos. Y si los resultados no son buenos, la investigación se suspende inmediatamente. Las pruebas se realizan con voluntarios sanos y hay que destacar que son conscientes de lo que puede causar este medicamento y que pueden abandonarlo cuando lo deseen.
En los inicios de las sesiones clínicas lo más difícil es decidir qué dosis utilizar. El punto de partida son los experimentos con animales, con una dosis inicial del 1-2% de lo efectivo en los animales y una dosis máxima del 10-16% del máximo permitido por los animales. En los primeros estudios se administra una única dosis, y tras ver lo que ocurre se decide si dar la siguiente o no. Poco a poco la dosis aumenta hasta que se detectan efectos inaceptables.
Con el menor número de participantes posible (30-100) se pretende obtener la máxima información posible. Para ver cómo el cuerpo toma la medicación, se miden las constantes vitales y la actividad cardiaca y se realizan análisis de sangre y orina. Posteriormente se realizan estudios farmacodinámicas (medicamentos y sus efectos sobre el cuerpo) y farmacocinéticos (cómo afecta el metabolismo del cuerpo al fármaco) y se observa su interacción con otros alimentos y/o fármacos. Todo ello demuestra si es seguro o no. Las pruebas también sirven para decidir cuándo y cómo administrarlas.
Unidad de Desarrollo Farmacéutico de Vitoria-Gasteiz

El trabajo iniciado en la Facultad de Química de San Sebastián podría continuar en la Facultad de Farmacia de Vitoria-Gasteiz. En concreto, dentro de la Fundación LEIA, la Unidad de Desarrollo Farmacéutico está formada por el Departamento de Farmacia y Tecnología Farmacéutica y la Unidad de Ensayos Clínicos del Hospital de Txagorritxu.
En la Facultad de Farmacia estudian las moléculas candidatas y definen sus características. Si ven que una molécula es válida, preparan el medicamento. Posteriormente, en la Unidad de Ensayos Clínicos del Hospital de Txagorritxu se realizan sesiones con voluntarios de la primera fase. Los análisis de sangre y orina que se deben realizar también se realizan en esta sección de Farmacia. Si todo va bien pasan a la segunda fase de las sesiones clínicas, pero para ello necesitan la colaboración de otros hospitales.
Además, en Vitoria-Gasteiz se preparan y prueban los medicamentos genéricos, algunos de los cuales se comercializan a través del laboratorio Litaphar de Azpeitia.
Seguro sí, pero... ¿es eficaz?

En una segunda fase se analiza la curación del medicamento. Hasta entonces sólo se ha mirado a la seguridad, pero la no afección no significa que se beneficie. En una segunda fase se realizan pruebas para comprobar el posible efecto beneficioso y determinar las normas y dosis más adecuadas para la administración del medicamento.
La segunda fase dura entre uno y tres años y requiere la participación de entre 100 y 400 personas, algunas de ellas pacientes. Finalmente se conoce la relación dosis-efecto. En las sesiones siempre hay un grupo de control y los exámenes suelen ser aleatorios y ciegos, es decir, el participante no sabe si está tomando el medicamento o el placebo. A veces se realizan sesiones dobles ciegas, es decir, el investigador que da la medicina a los participantes tampoco sabe lo que está tomando. De esta manera, los resultados son más objetivos.
Última fase pre-comercial
La tercera fase recoge las últimas pruebas realizadas antes de la comercialización del medicamento. En esta fase se compara el medicamento con otros medicamentos ya existentes en el mercado y de igual uso terapéutico. Además, los exámenes se realizan como si los pacientes estuvieran en situación normal, es decir, deben tomar la dosis en la misma hora y en el mismo estado en que deberían tomar la medicación, seguir con la actividad normal y la comida...

No hay que olvidar que el medicamento está dirigido a pacientes. Por ello, los voluntarios de la tercera fase deben sustituir lo mejor posible a los pacientes que van a recibir el medicamento. Sin embargo, no siempre es fácil, ya que la realización de pruebas con enfermos, vulnerables, niños, ancianos y embarazadas genera problemas éticos.
Estos equipos son más vulnerables que el resto, por lo que algunos investigadores los excluyen de las pruebas. La sobreprotección, sin embargo, no suele ser beneficiosa porque la población excluida en los ensayos, si algún día necesita este medicamento, nadie sabrá cuál será su efecto.
Al margen de esto, hay que tener muy claro qué se quiere conseguir en la tercera fase, cuánto tiempo y cuánto dinero se quiere gastar. De hecho, muchos nuevos medicamentos son más eficaces que los existentes, pero hay que ver hasta qué punto la diferencia es tan grande que muchas veces no es muy grande. En estos casos, quizás sea mejor suspender la investigación, ya que la diferencia no merece tanto dinero y tiempo.
Tras el despido hay que seguir investigando

Con toda la información recopilada en las tres primeras fases de las sesiones clínicas, se elaboran los informes de solicitud de autorización de comercialización. Teniendo en cuenta dónde se quiere comercializar, los informes se envían a la Agencia Española del Medicamento, a la Agencia Europea o a la Administración de Alimentos y Medicamentos (FDA) de EE.UU. para que, tras un análisis exhaustivo, autoricen o denieguen el despido.
Pero a la hora de decidir, muchas veces pasa mucho tiempo, ya que a menudo piden que se completen los datos o que se hagan más pruebas. Según Lidia Larrañaga, directora técnica del laboratorio Litaphar de Azpeitia, en el caso de los medicamentos genéricos este proceso dura aproximadamente un año. Lógicamente, cuando el medicamento es completamente nuevo, el proceso de obtención de la autorización se alarga mucho.
Una vez autorizado, el medicamento sale al mercado. Es entonces cuando comienza la cuarta fase de las sesiones clínicas. El objetivo de esta fase es el seguimiento de la eficacia y seguridad del medicamento. Bastantes veces ocurre, por ejemplo, que las dosis establecidas son demasiado altas, por lo que se vuelve a publicar con dosis más bajas. En menor medida, pueden aparecer efectos secundarios graves en algún grupo de la población que no fueron detectados en sesiones clínicas. Esto puede obligar a retirar el medicamento del mercado.
Otras veces, gracias a los estudios que se realizan en esta fase, se encuentran nuevos usos. Por ejemplo, la aspirina lleva 105 años en el mercado. Al principio salió para eliminar el dolor y tratar las inflamaciones, pero ahora se sabe que también es beneficioso para prevenir los infartos y se están realizando pruebas para utilizarlo en la lucha contra el cáncer.
Está claro que el lanzamiento de un nuevo medicamento es un trabajo penoso, largo y caro. A cambio, hay remedios contra muchas enfermedades. No obstante, en ocasiones se abusa de la medicación y la toma de medida depende del médico y de cada uno.
El futuro comienza hoy
XX. La farmacología del siglo XX avanzó mucho gracias a la química, la farmacología y la clínica. A partir de ahora, los expertos creen que los avances se centrarán en la biología molecular, el genoma y la proteoma, la biotecnología, la química combinatoria, la bioinformática y la robótica.

Sin duda, la identificación de los genes ha supuesto una nueva forma de entender las enfermedades. Conociendo el control genético de las funciones de la célula, se abren nuevas vías para prevenir o curar enfermedades. Independientemente de la terapia génica, el conocimiento del genoma lleva a descubrir los destinos de los nuevos medicamentos. Proteómica, por su parte, analiza el producto del genoma, por lo que complementa al anterior.
Por otro lado, existen diferencias entre los grupos étnicos a la hora de metabolizar los medicamentos, y es posible que un medicamento que beneficia a la mayoría pueda causar daños a algunos. La farmacogenética estudia la relación entre el genotipo individual y la capacidad de metabolización de los medicamentos.
La química combinatoria ha supuesto un gran avance en la química de síntesis. La tecnología actual permite obtener moléculas de interés más rápido que nunca. Para conocer cuáles de estas moléculas son realmente de valor terapéutico se utilizan métodos rápidos de cribado de alta eficacia. Así, se conocen con precisión y rigor los distintivos de entre 50.000 y 60.000 moléculas a la semana. Todo ello se debe a la bioinformática como herramienta imprescindible para la rápida comprensión y tratamiento de tantos datos.
Sin embargo, no deben evitarse las sustancias naturales con capacidad curativa. Hasta el momento sólo se ha explotado el 10% de los recursos de la Tierra, por lo que aún quedan muchos tesoros ocultos. Para ser conscientes de su importancia, basta con ver cuáles son los medicamentos más vendidos, como la ciclosporina, la lobastatina, la claritromicina, la pravatatina y la altobastatina, nueve de los diez medicamentos no proteicos que más se vendieron año pasado en EE.UU.

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia