Células madre: agentes de la biomedicina del futuro
2021/07/12 Ainhoa González Pujana - EHUko NanoBioCel taldeko ikertzailea | Rosa María Hernández Martín - EHUko NanoBioCel taldeko ikertzailea | Edorta Santos Vizcaíno - EHUko NanoBioCel taldeko ikertzailea Iturria: Elhuyar aldizkaria
¿Qué son las células madre y qué efectos terapéuticos tienen?
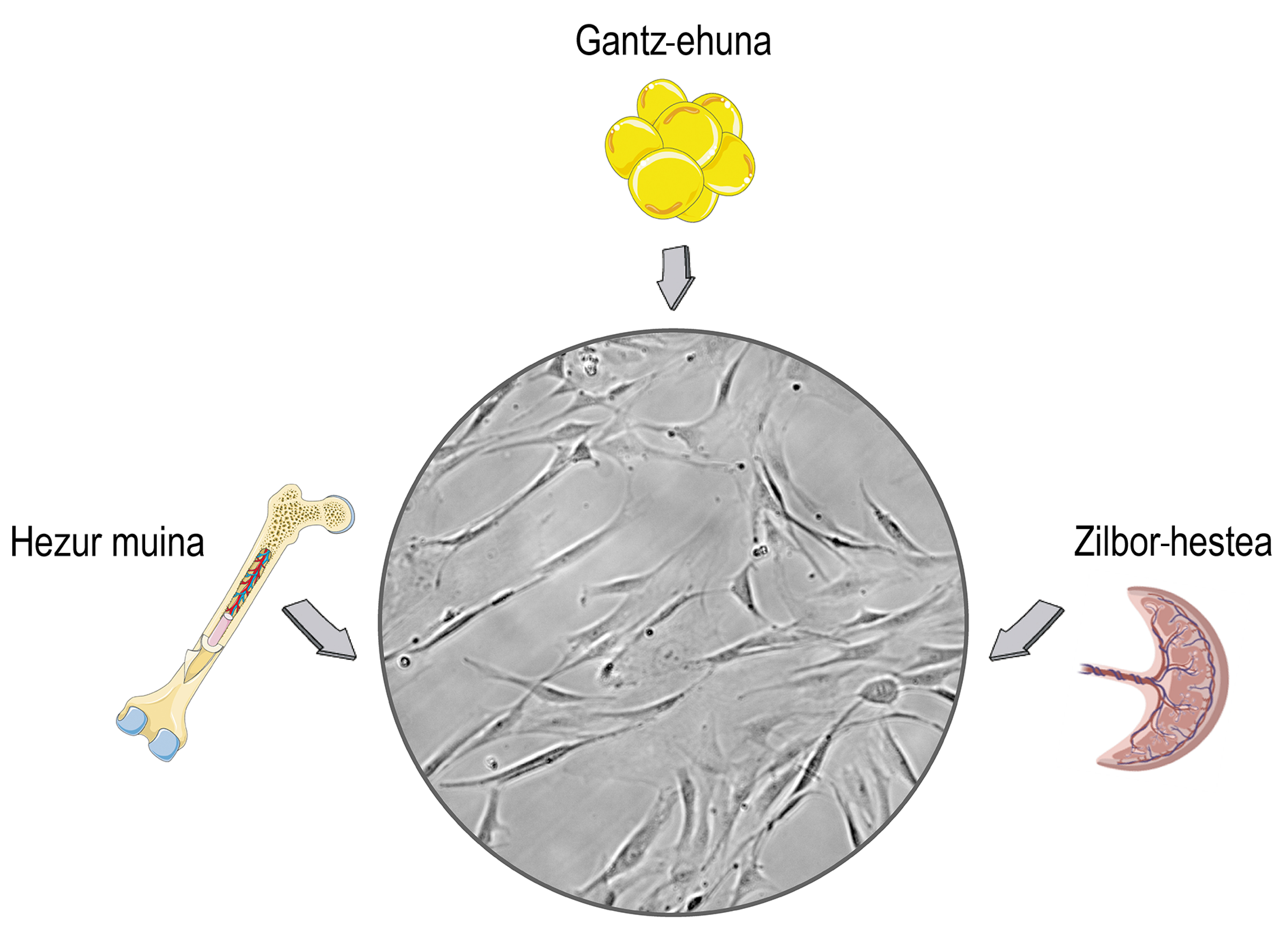
Las células madre son células que se encuentran en los tejidos estromales de los mamíferos. Seguramente relacionas su uso con debates éticos y religiosos, y esa preocupación está relacionada con su origen. Las células madre se pueden aislar de los tejidos embrionarios, lo que puede causar problemas morales. El problema es que las células madre también las podemos obtener de los organismos maduros y dejar de lado esos problemas. En consecuencia, en la mayoría de las investigaciones se aíslan de los donantes adultos, principalmente del cordón umbilical, la médula ósea y el tejido adiposo (Figura 1).
La motivación principal del uso de estas células son sus características terapéuticas. Entre ellas, la más conocida es su capacidad de transformación hacia otros tipos de células. Según el número de tipos de células que se pueden distinguir, se clasifican en cuatro clases: (1) totipotentes, que pueden diferenciarse en todas las células de los tejidos embrionarios y no embrionarios (placenta) y que tienen la capacidad de formar un organismo completo; (2) pluripotentes, que pueden distinguirse en las células de todos los linajes embrionarios; (3) multipotentes, que sólo se distinguen en las células del lino embrionario de su origen; y (4) unipotentes, que se diferencian en un único tipo de células. Gracias a esta capacidad, las células madre tienen un gran potencial para curar y regenerar tejidos. Su uso se ha estudiado en profundidad en la renovación ósea y cartílago.
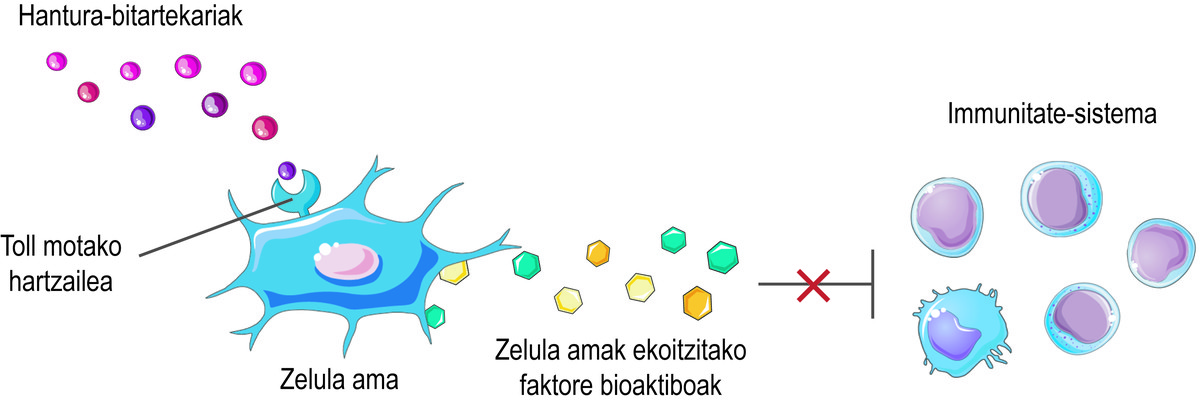
Además de esta capacidad regenerativa, las células madre tienen otro efecto terapéutico importante: pueden regular el sistema inmunitario. Aunque su acción inmunomoduladora es el resultado de una compleja combinación de varios mecanismos, los factores bioactivos que producen y liberan las células son considerados como los principales responsables de esta actividad. Entre ellas se encuentran las interleucas, las enzimas metabólicas, los factores de crecimiento y las quimioquinas, que interactúan con las células inmunes y regulan su efecto.
Pero, ¿cómo saben que las células madre deben liberar los factores bioactivos? Las células madre perciben lo que está sucediendo en su micromedio a través de sus receptores de tipo Toll en superficie, tratando de equilibrar la situación. Por ejemplo, en el inicio de una lesión, perciben que hay pocos intermediarios inflamatorios en el medio y la consideran una señal de activación del sistema inmunitario. En consecuencia, las células madre segregan diversos factores bioactivos que activan la respuesta inmune para iniciar el proceso de curación de esta lesión. A medida que el sistema inmunitario cumple su función, libera mediadores inflamatorios. De esta forma, cuando se realiza el proceso, el nivel de los citados mediadores inflamatorios es elevado. Al detectarlo, las células madre liberan factores bioactivos que inhiben la respuesta inmune y favorecen la curación y homeostasis de los tejidos (Figura 2).
Teniendo en cuenta la sobreactivación del sistema inmunitario en muchas enfermedades, las células madre se han convertido en una excelente alternativa terapéutica. De hecho, reduciendo la respuesta inmune atacan el origen de la enfermedad. Entre otras cosas, se ha estudiado en profundidad el uso de células madre para tratar la enfermedad del injerto versus hostal, la enfermedad inflamatoria intestinal o la esclerosis múltiple, obteniendo resultados esperanzadores.
Retos a superar para lograr la traslación clínica de células madre
A pesar de ser una terapia prometedora, hay que superar algunos retos para acercar los tratamientos basados en células madre a la clínica. Por un lado, es urgente optimizar los protocolos de entrega. Tras la administración intravenosa, el sistema inmunológico del huésped elimina las células madre en poco tiempo y reduce considerablemente la efectividad de la terapia. Además, un porcentaje importante de las células queda almacenado en los capilares pulmonares, mientras que el resto se expande en el cuerpo. Esto puede causar problemas de seguridad.
Por otro lado, como ya se ha mencionado anteriormente, la presencia de mediadores inflamatorios es imprescindible para que las células madre inhiban la influencia del sistema inmunitario. El problema es que en muchas enfermedades el grado de estos intermediarios es escaso, por lo que las células no reciben señales para liberar los factores bioactivos que limitan la inmunidad. Por ello, en la actualidad, la comunidad científica está realizando un gran esfuerzo para desarrollar estrategias que promuevan las capacidades inmunomoduladoras de las células madre. Entre las alternativas destaca la estimulación de células madre con intermediarios inflamatorios, es decir, la estimulación inflamatoria. En concreto, se ha demostrado que al estimular células madre con interferón gamma (ifn-{), factor necrosis del tumor alfa (tnf-?) u otros mediadores inflamatorios similares antes de administrarse, mejora notablemente la liberación de ciertos factores bioactivos. Sin embargo, el efecto de esta estimulación es efímero y desaparece en el futuro. Desgraciadamente esto no es suficiente para tratar enfermedades crónicas, por lo que es imprescindible encontrar estrategias que mantengan el efecto regulador de las células madre a largo plazo.
Sistemas de donación que favorecen la acción terapéutica de células madre
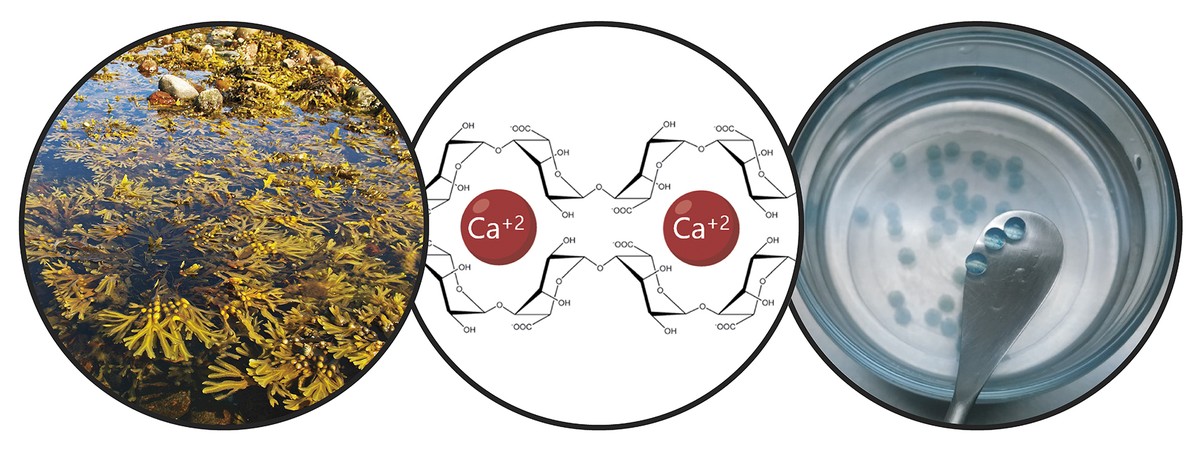
Teniendo en cuenta las limitaciones mencionadas, el objetivo principal de la tesis ha sido el desarrollo de un sistema de donación que impulsa la retención de células madre y la acción terapéutica a largo plazo. En concreto, en este nuevo sistema de donación hemos combinado dos estrategias. Por un lado, para garantizar la retención de las células y fomentar su viabilidad, las hemos encapsulado en un hidrogel. Un hidrogel es una estructura reticular tridimensional con cadenas flexibles, en nuestro caso de alginato. El alginato es un polímero natural que se encuentra en las algas marrones. Entre las ventajas que ofrece el alginato destacan la biocompatibilidad, la baja toxicidad y la capacidad de formar hidrogeles en condiciones normales. Estas características son imprescindibles en la tecnología de encapsulado celular. Los alginatos hidrogelaspueden prepararse utilizando varios métodos de reticulación, pero el más utilizado es el cruce iónico entre cadenas de polímeros y cationes divalentes, que a menudo se realiza a través del calcio (Figura 3). Los hidrogeles obtenidos presentan un alto contenido en agua y similitudes mecánicas con los tejidos blandos. En nuestro caso, en esta red tridimensional que genera el alginato hemos incluido el colágeno, ya que al imitar el micromedio natural de las células se fomenta su viabilidad.
Estos hidrogeles pueden aplicarse en más de un lugar del cuerpo, como la cavidad peritoneal o la piel. Una vez administrado, el implante quedará en esa posición y garantizará la retención celular. Por otra parte, el hidrogel protege a las células madre del sistema inmunitario del huésped, evitando la entrada de células inmunes y anticuerpos. En este punto es importante determinar que la estructura polimérica del hidrogel permite la difusión de los factores bioactivos liberados por las células madre. De esta forma, nuestro sistema permite mantener las células encapsuladas en el emplazamiento dado y liberar de forma sostenible los factores bioactivos. De hecho, en los ensayos preclínicos que hemos realizado con los ratones, los hidrogeles que encapsulan células madre se han mantenido a largo plazo bajo la piel. De hecho, al recuperar los implantes 45 días después de su colocación, hemos analizado las células y hemos comprobado que siguen vivos.
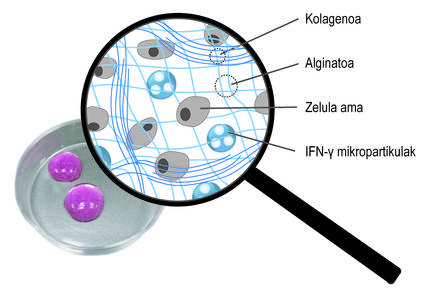
Además de la encapsulación tridimensional, hemos utilizado una segunda estrategia para promover la acción terapéutica de las células. En concreto, la idea ha sido estimular constantemente células madre con mediadores inflamatorios. Para ello, se han incluido en la red tridimensional de la red de alginato-colágeno hidrogel micropartículas esféricas cargadas con el mediador ifn-{ (Figura 4). Nuestros estudios han demostrado que este sistema combinado permite mantener un microambiente inflamatorio continuo. Así, las células madre producen durante más tiempo factores bioactivos que inhiben el sistema inmunitario. Por otro lado, se ha comprobado que al cultivar células madre encapsuladas en estos nuevos hidrogeles con células del sistema inmunitario, se inhibe el efecto de estas últimas. Esto demuestra el buen funcionamiento del sistema.
En general, este nuevo sistema de donación que aúna ambas estrategias, además de impulsar y prolongar la acción terapéutica de las células, garantiza su retención y viabilidad, lo que puede implicar importantes implicaciones en terapias basadas en estas células.
Bibliografía
J. Galipeau and L. Sensebe, Cell. Stem Cell. 2018, 22, 824-833 (DOI:10.1016/j.stem.2018.05.004).
L. J. Scott, BioDrugs, 2018, 32, 627-634 (DOI:10.1007/s40259-018-0311-4).
C. Muroi, K. Miyamura, M. Ocada, T. Yamashita, M. Murata, T. Ishikawa, N. Uike, M. Hidaka, R. Kobayashi, M. Imamura, J. Tanaka, K. Ohashi, S. Taniguchi, T. Ikeda, T. Eto, M. Mori, M. Yamaoka and K. Ozawa, Int. J. Hematol, 2016, 103, 243-250 (DOI:10.1007/s12185-015-1915-9).
A. Gonzalez-Pujana, K. H. Vining, D. C. Y. Zhang, E. Santos-Vizcaino, M. Igartua, R. M. Hernandez and D. J. Mooney, Biomaterials, 2020, 257, 120266 (DOI:S0142-9612(20)30512-3).
J. R. Ferreira, G. Q. Teixeira, S. G. Santos, M. A. Barbosa, G. Almeida-Porada and R. M. Goncalves, Front. Inmunol, 2018, 9, 2837 (DOI:10.3389/fimmu.2018.02837).
A. Gonzalez-Pujana, M. Igartua, E. Santos-Vizcaino and R. M. Hernandez, Symphone Opin. Drug Deliv. 2020, 17, 189-200 (DOI:10.1080/17425247.2020.1714587).

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia



_galeria.jpg)