Cellules souches : agents de la biomédecine du futur
2021/07/12 Ainhoa González Pujana - EHUko NanoBioCel taldeko ikertzailea | Rosa María Hernández Martín - EHUko NanoBioCel taldeko ikertzailea | Edorta Santos Vizcaíno - EHUko NanoBioCel taldeko ikertzailea Iturria: Elhuyar aldizkaria
Que sont les cellules souches et quels effets thérapeutiques ont-ils?
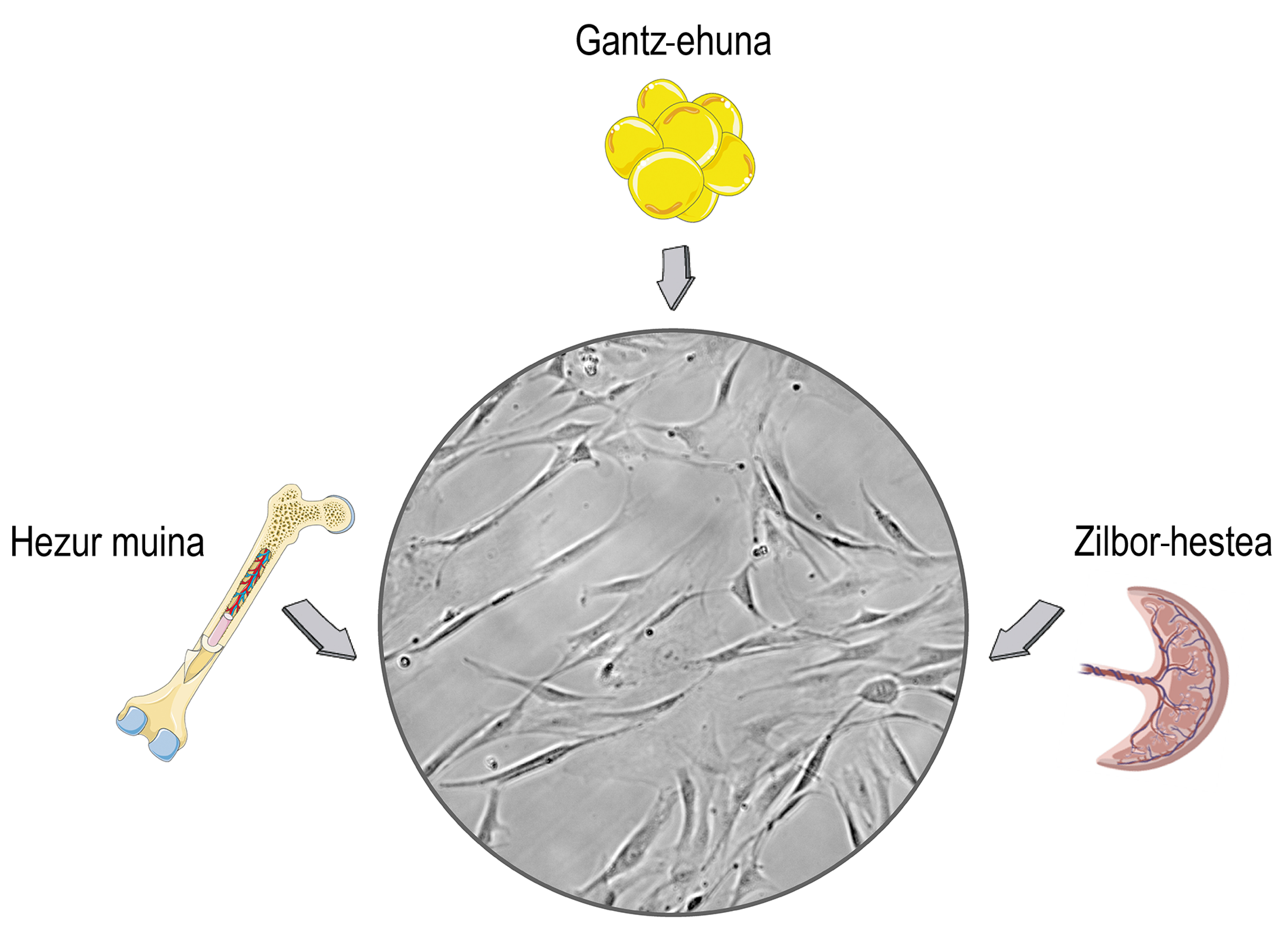
Les cellules souches sont des cellules qui se trouvent dans les tissus stromaux des mammifères. Vous reliez sûrement leur utilisation à des débats éthiques et religieux, et cette préoccupation est liée à leur origine. Les cellules souches peuvent être isolées des tissus embryonnaires, ce qui peut causer des problèmes moraux. Le problème est que les cellules souches peuvent également les obtenir des organismes mûrs et mettre de côté ces problèmes. Par conséquent, la plupart des recherches sont isolées des donneurs adultes, principalement du cordon ombilical, de la moelle osseuse et du tissu adipeux (figure 1).
La motivation principale de l'utilisation de ces cellules sont leurs caractéristiques thérapeutiques. Parmi elles, la plus connue est sa capacité de transformation vers d'autres types de cellules. Selon le nombre de types de cellules qui peuvent être distingués, ils sont classés en quatre classes: (1) totiphores, qui peuvent se différencier dans toutes les cellules des tissus embryonnaires et non embryonnaires (placenta) et qui ont la capacité de former un organisme complet; (2) pluripuissants, qui peuvent se distinguer dans les cellules de toutes les lignées embryonnaires; (3) multipuissantes, qui ne se distinguent que dans les cellules du lin embryonnaire de leur origine; et (4) unipuissants, qui se différencient en cellules. Grâce à cette capacité, les cellules souches ont un grand potentiel pour guérir et régénérer des tissus. Son utilisation a été étudiée en profondeur dans le renouvellement osseuse et cartilage.
En plus de cette capacité régénérative, les cellules souches ont un autre effet thérapeutique important : elles peuvent réguler le système immunitaire. Bien que son action immunomodulatrice soit le résultat d'une combinaison complexe de plusieurs mécanismes, les facteurs bioactifs qui produisent et libèrent les cellules sont considérés comme les principaux responsables de cette activité. Les interleukines, les enzymes métaboliques, les facteurs de croissance et les chimiokines, qui interagissent avec les cellules immunitaires et régulent leur effet.
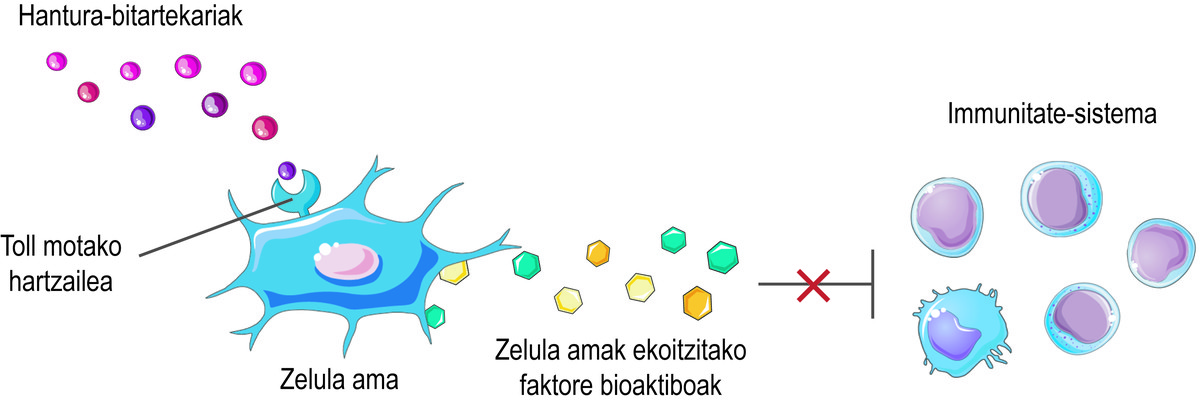
Mais comment savez-vous que les cellules souches doivent libérer les facteurs bioactifs ? Les cellules souches perçoivent ce qui se passe dans leur micro-siège à travers leurs récepteurs de type Toll en surface, en essayant d'équilibrer la situation. Par exemple, au début d'une blessure, ils perçoivent qu'il y a peu d'intermédiaires inflammatoires dans le milieu et la considèrent comme un signe d'activation du système immunitaire. En conséquence, les cellules souches sécrètent divers facteurs bioactifs qui activent la réponse immunitaire pour commencer le processus de guérison de cette lésion. Comme le système immunitaire remplit sa fonction, il libère des médiateurs inflammatoires. Ainsi, lorsque le processus est effectué, le niveau des médiateurs inflammatoires mentionnés ci-dessus est élevé. En le détectant, les cellules souches libèrent des facteurs bioactifs qui inhibent la réponse immunitaire et favorisent la guérison et l'homéostasie des tissus (Figure 2).
Compte tenu de la suractivation du système immunitaire dans de nombreuses maladies, les cellules souches sont devenues une excellente alternative thérapeutique. En fait, en réduisant la réponse immunitaire attaquent l'origine de la maladie. Entre autres choses, on a étudié en profondeur l'utilisation de cellules souches pour traiter la maladie de l'greffe versus hostal, la maladie inflammatoire intestinale ou la sclérose en plaques, obtenant des résultats encourageants.
Défis à surmonter pour atteindre la translation clinique des cellules souches
En dépit d'être une thérapie prometteuse, il faut surmonter quelques défis pour rapprocher les traitements à base de cellules souches à la clinique. D'une part, il est urgent d'optimiser les protocoles de livraison. Après l'administration intraveineuse, le système immunitaire de l'hôte élimine les cellules souches en peu de temps et réduit considérablement l'efficacité de la thérapie. En outre, un pourcentage important des cellules est stocké dans les capillaires pulmonaires, tandis que le reste se développe dans le corps. Cela peut causer des problèmes de sécurité.
D'autre part, comme mentionné ci-dessus, la présence de médiateurs inflammatoires est indispensable pour que les cellules souches inhibent l'influence du système immunitaire. Le problème est que dans de nombreuses maladies le degré de ces intermédiaires est faible, de sorte que les cellules ne reçoivent aucun signe pour libérer les facteurs bioactifs qui limitent l'immunité. C'est pourquoi, aujourd'hui, la communauté scientifique fait un grand effort pour développer des stratégies qui favorisent les capacités immunomodulatrices des cellules souches. Parmi les alternatives se distingue la stimulation des cellules souches avec des intermédiaires inflammatoires, à savoir la stimulation inflammatoire. En particulier, il a été démontré qu'en stimulant des cellules souches avec interféron gamma (ifn-{), facteur nécrose de la tumeur alpha (tnf-?) ou d'autres médiateurs inflammatoires similaires avant leur administration, il améliore considérablement la libération de certains facteurs bioactifs. Cependant, l'effet de cette stimulation est éphémère et disparaît à l'avenir. Malheureusement, cela ne suffit pas pour traiter les maladies chroniques, il est donc impératif de trouver des stratégies qui maintiennent l'effet régulateur des cellules souches à long terme.
Systèmes de donation qui favorisent l’action thérapeutique des cellules souches
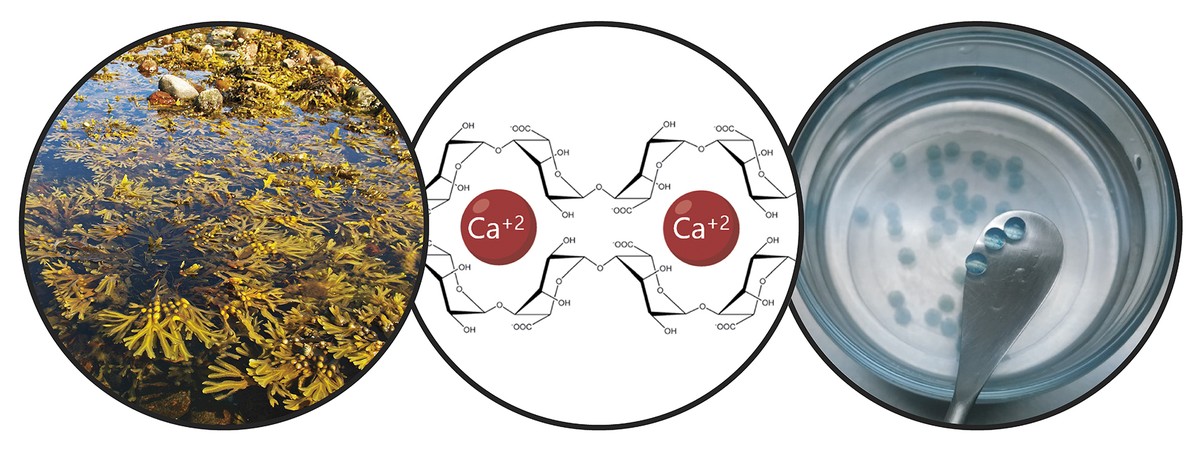
Compte tenu des limites mentionnées, l'objectif principal de la thèse a été le développement d'un système de donation qui favorise la rétention des cellules souches et l'action thérapeutique à long terme. Concrètement, dans ce nouveau système de donation, nous avons combiné deux stratégies. D'une part, pour assurer la rétention des cellules et favoriser leur viabilité, nous les avons encapsulées dans un hydrogel. Un hydrogel est une structure tridimensionnelle réticulaire avec des chaînes flexibles, dans notre cas d'alginate. L'alginate est un polymère naturel qui se trouve dans les algues brunes. Parmi les avantages offerts par l'alginate, la biocompatibilité, la faible toxicité et la capacité de former des hydrogels dans des conditions normales. Ces caractéristiques sont indispensables dans la technologie du boîtier cellulaire. Les alginates hydrogélaspeuvent être préparés en utilisant plusieurs méthodes de réticulation, mais le plus utilisé est le croisement ionique entre chaînes de polymères et cations divalentes, qui se fait souvent à travers le calcium (Figure 3). Les hydrogels obtenus présentent une teneur élevée en eau et des similitudes mécaniques avec les tissus mous. Dans notre cas, dans ce réseau tridimensionnel qui génère l'alginate, nous avons inclus le collagène, car en imitant le micromsiège naturel des cellules, sa viabilité est encouragée.
Ces hydrogels peuvent être appliqués sur plusieurs endroits du corps, tels que la cavité péritonéale ou la peau. Une fois administré, l'implant restera dans cette position et garantira la rétention cellulaire. En outre, l'hydrogel protège les cellules souches du système immunitaire de l'hôte, en évitant l'entrée des cellules immunitaires et des anticorps. À ce stade, il est important de déterminer que la structure polymère de l'hydrogel permet la diffusion des facteurs bioactifs libérés par les cellules souches. De cette façon, notre système permet de maintenir les cellules encapsulées sur le site donné et de libérer durablement les facteurs bioactifs. En fait, dans les essais précliniques que nous avons effectués avec des souris, les hydrogels qui encapsulent des cellules souches ont été maintenus à long terme sous la peau. En fait, en récupérant les implants 45 jours après leur placement, nous avons analysé les cellules et vérifié qu'elles sont encore en vie.
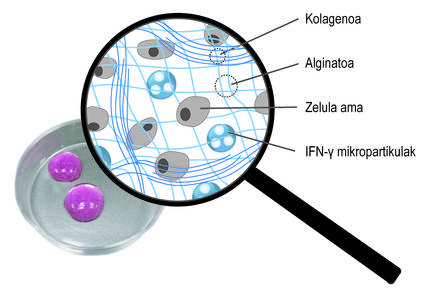
En plus de l'encapsulation tridimensionnelle, nous avons utilisé une deuxième stratégie pour promouvoir l'action thérapeutique des cellules. Plus précisément, l'idée a été de stimuler constamment cellules souches avec des médiateurs inflammatoires. Pour ce faire, des microparticules sphériques chargées avec le médiateur ifn-{ ont été intégrées dans le réseau tridimensionnel du réseau alginato-collagène (figure 4). Nos études ont montré que ce système combiné permet de maintenir un microenvironnement inflammatoire continu. Ainsi, les cellules souches produisent plus longtemps des facteurs bioactifs qui inhibent le système immunitaire. D'autre part, on a constaté qu'en cultivant des cellules souches encapsulées dans ces nouveaux hydrogels avec des cellules du système immunitaire, l'effet de ces dernières est inhibé. Cela montre le bon fonctionnement du système.
En général, ce nouveau système de donation qui combine les deux stratégies, en plus de stimuler et de prolonger l'action thérapeutique des cellules, garantit leur conservation et leur viabilité, ce qui peut entraîner d'importantes implications dans des thérapies basées sur ces cellules.
Bibliographie Bibliographie
J. Galipeau and L. Sensebe, Cell. Stem Cell. 2018, 22, 824-833 (DOI:10.1016/j.stem.2018.05.004).
L. J. Scott, BioDrugs, 2018, 32, 627-634 (DOI:10.1007/s40259-018-0311-4).
C. Muroi, K. Miyamura, M. Ocada, T. Yamashita, M. Murata, T. Ishikawa, N. Uike, M. Hidaka, R. Kobayashi, M. Imamura, J. Tanaka, K. Ohashi, S. Taniguchi, T. Ikeda, T. Eto, M. Mori, M. Yamaoka and K. Ozawa, Int. J. Hématol, 2016, 103, 243-250 (DOI:10.1007/s12185-015-1915-9).
A. Gonzalez-Pujana, K. H. Vining, D. C. Et. Zhang, E. Santos-Vizcaino, M. Igartua, R. M. Hernandez and D. J. Mooney, Biomaterials, 2020, 257, 120266 (DOI:S0142-9612(20)30512-3).
J. R. Ferreira, G. Q. Teixeira, S. G. Santos, M. A. Barbosa, G. Almeida-Porada and R. M. Goncalves, Front. Immunol, 2018, 9, 2837 (DOI:10.3389/fimmu.2018.02837).
A. Gonzalez-Pujana, M. Igartua, E. Santos-Vizcaino and R. M. Hernandez, Symphone Opin. Drug Deliv. 2020, 17, 189-200 (DOI:10.1080/17425247.2020.1714587).

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia



_galeria.jpg)