Células nai: axentes da biomedicina do futuro
2021/07/12 Ainhoa González Pujana - EHUko NanoBioCel taldeko ikertzailea | Rosa María Hernández Martín - EHUko NanoBioCel taldeko ikertzailea | Edorta Santos Vizcaíno - EHUko NanoBioCel taldeko ikertzailea Iturria: Elhuyar aldizkaria
Que son as células nai e que efectos terapéuticos teñen?
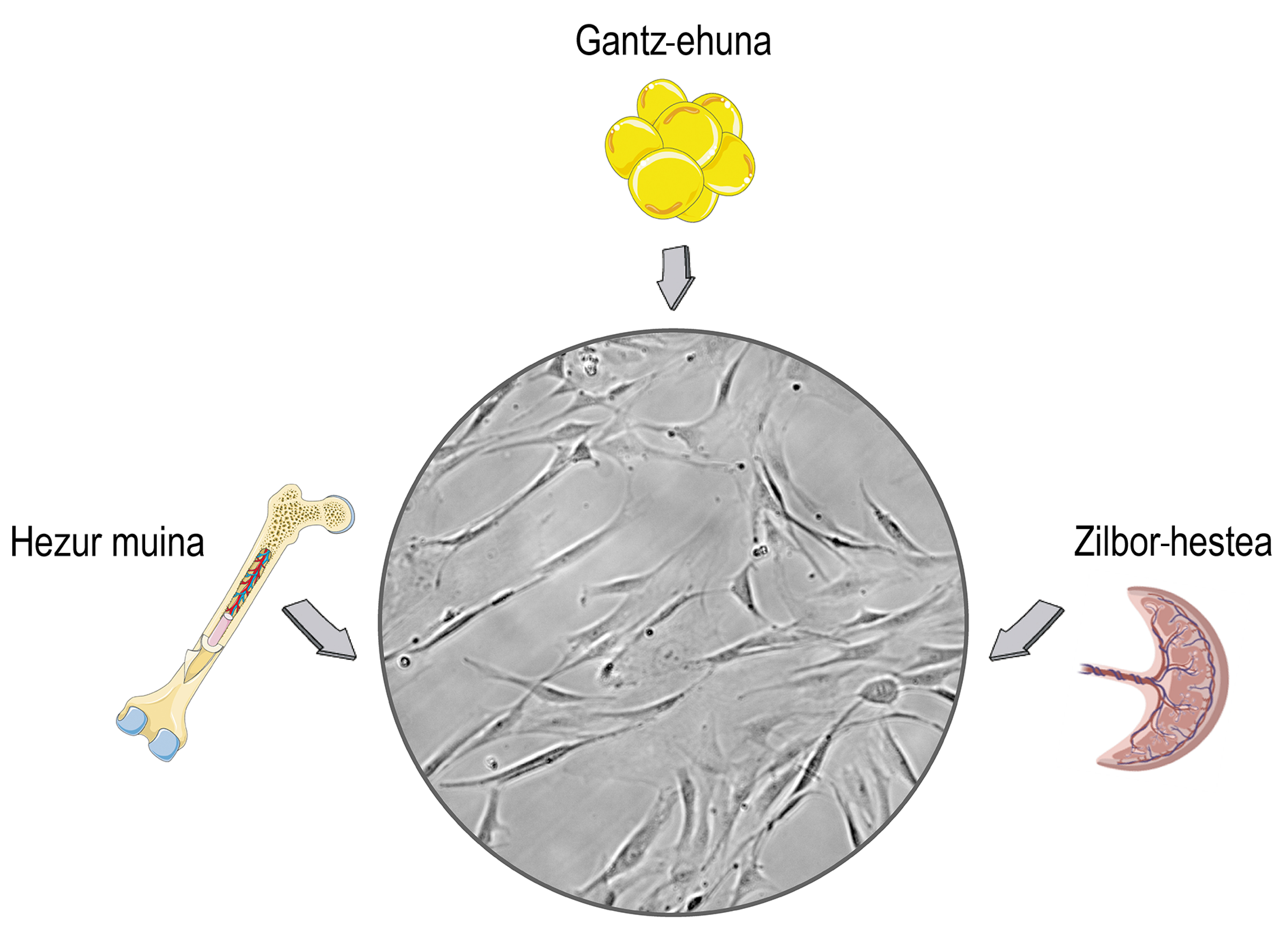
As células nai son células que se atopan nos tecidos estromales dos mamíferos. Seguramente relacionas o seu uso con debates éticos e relixiosos, e esa preocupación está relacionada coa súa orixe. As células nai pódense illar dos tecidos embrionarios, o que pode causar problemas morais. O problema é que as células nai tamén as podemos obter dos organismos maduros e deixar de lado eses problemas. En consecuencia, na maioría das investigacións íllanse dos doantes adultos, principalmente do cordón umbilical, a medula ósea e o tecido adiposo (Figura 1).
A motivación principal do uso destas células son as súas características terapéuticas. Entre elas, a máis coñecida é a súa capacidade de transformación cara a outros tipos de células. Segundo o número de tipos de células que se poden distinguir, clasifícanse en catro clases: (1) totipotentes, que poden diferenciarse en todas as células dos tecidos embrionarios e non embrionarios (placenta) e que teñen a capacidade de formar un organismo completo; (2) pluripotentes, que poden distinguirse nas células de todas as liñaxes embrionarias; (3) multipotentes, que só se distinguen nas células do liño embrionario da súa orixe; e (4) unipotentes, que se diferencian nun único tipo de células. Grazas a esta capacidade, as células nai teñen un gran potencial paira curar e rexenerar tecidos. O seu uso estudouse en profundidade na renovación ósea e cartílago.
Ademais desta capacidade regenerativa, as células nai teñen outro efecto terapéutico importante: poden regular o sistema inmunitario. Aínda que a súa acción inmunomoduladora é o resultado dunha complexa combinación de varios mecanismos, os factores bioactivos que producen e liberan as células son considerados como os principais responsables desta actividade. Entre elas atópanse as interleucas, as encimas metabólicas, os factores de crecemento e as quimioquinas, que interactúan coas células inmunes e regulan o seu efecto.
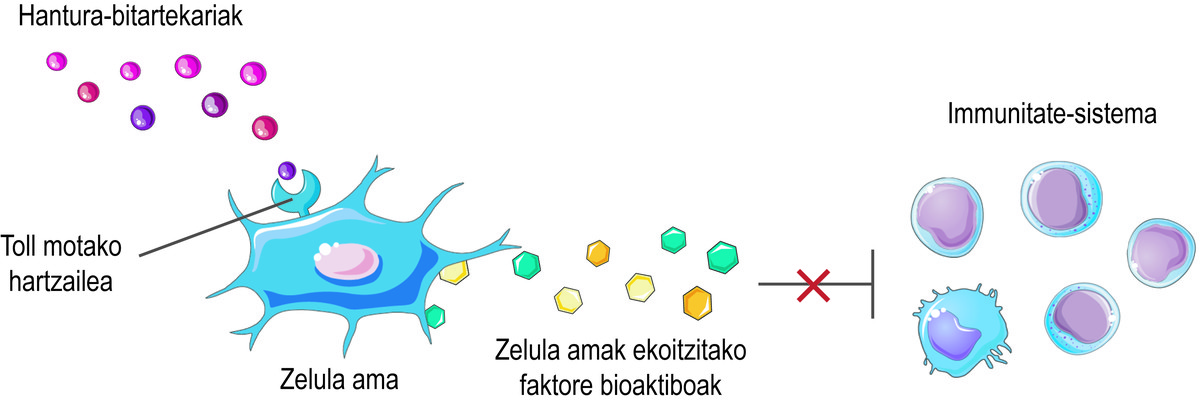
Pero, como saben que as células nai deben liberar os factores bioactivos? As células nai perciben o que está a suceder na súa micromedio a través dos seus receptores de tipo Toll en superficie, tratando de equilibrar a situación. Por exemplo, no inicio dunha lesión, perciben que hai poucos intermediarios inflamatorios no medio e considérana una sinal de activación do sistema inmunitario. En consecuencia, as células nai segregan diversos factores bioactivos que activan a resposta inmune paira iniciar o proceso de curación desta lesión. A medida que o sistema inmunitario cumpre a súa función, libera mediadores inflamatorios. Desta forma, cando se realiza o proceso, o nivel dos citados mediadores inflamatorios é elevado. Ao detectalo, as células nai liberan factores bioactivos que inhiben a resposta inmune e favorecen a curación e homeostasis dos tecidos (Figura 2).
Tendo en conta a sobreactivación do sistema inmunitario en moitas enfermidades, as células nai convertéronse nunha excelente alternativa terapéutica. De feito, reducindo a resposta inmune atacan a orixe da enfermidade. Entre outras cousas, estudouse en profundidade o uso de células nai paira tratar a enfermidade do enxerto versus hostal, a enfermidade inflamatoria intestinal ou a esclerose múltiple, obtendo resultados esperanzadores.
Retos a superar paira lograr a translación clínica de células nai
A pesar de ser una terapia prometedora, hai que superar algúns retos paira achegar os tratamentos baseados en células nai á clínica. Por unha banda, é urxente optimizar os protocolos de entrega. Tras a administración intravenosa, o sistema inmunológico do hóspede elimina as células nai en pouco tempo e reduce considerablemente a efectividade da terapia. Ademais, unha porcentaxe importante das células queda almacenado nos capilares pulmonares, mentres que o resto expándese no corpo. Isto pode causar problemas de seguridade.
Doutra banda, como xa se mencionou anteriormente, a presenza de mediadores inflamatorios é imprescindible para que as células nai inhiban a influencia do sistema inmunitario. O problema é que en moitas enfermidades o grao destes intermediarios é escaso, polo que as células non reciben sinais paira liberar os factores bioactivos que limitan a inmunidade. Por iso, na actualidade, a comunidade científica está a realizar un gran esforzo paira desenvolver estratexias que promovan as capacidades inmunomoduladoras das células nai. Entre as alternativas destaca a estimulación de células nai con intermediarios inflamatorios, é dicir, a estimulación inflamatoria. En concreto, demostrouse que ao estimular células nai con interferón gamma (ifn-{), factor necrosis do tumor alfa (tnf-?) ou outros mediadores inflamatorios similares antes de administrarse, mellora notablemente a liberación de certos factores bioactivos. Con todo, o efecto desta estimulación é efémero e desaparece no futuro. Desgraciadamente isto non é suficiente paira tratar enfermidades crónicas, polo que é imprescindible atopar estratexias que manteñan o efecto regulador das células nai a longo prazo.
Sistemas de doazón que favorecen a acción terapéutica de células nai
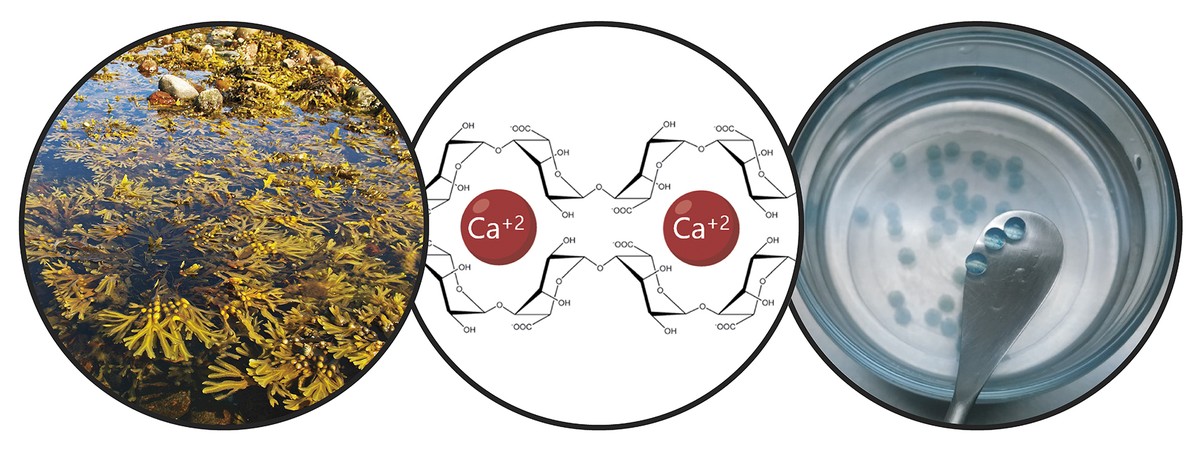
Tendo en conta as limitacións mencionadas, o obxectivo principal da tese foi o desenvolvemento dun sistema de doazón que impulsa a retención de células nai e a acción terapéutica a longo prazo. En concreto, neste novo sistema de doazón combinamos dúas estratexias. Por unha banda, paira garantir a retención das células e fomentar a súa viabilidade, habémolas encapsulado nun hidrogel. Un hidrogel é una estrutura reticular tridimensional con cadeas flexibles, no noso caso de alginato. O alginato é un polímero natural que se atopa nas algas marróns. Entre as vantaxes que ofrece o alginato destacan a biocompatibilidad, a baixa toxicidade e a capacidade de formar hidrogeles en condicións normais. Estas características son imprescindibles na tecnoloxía de encapsulado celular. Os alginatos hidrogelaspueden prepararse utilizando varios métodos de reticulación, pero o máis utilizado é o cruzamento iónico entre cadeas de polímeros e cationes divalentes, que a miúdo se realiza a través do calcio (Figura 3). Os hidrogeles obtidos presentan un alto contido en auga e similitudes mecánicas cos tecidos brandos. No noso caso, nesta rede tridimensional que xera o alginato incluímos o colágeno, xa que ao imitar o micromedio natural das células foméntase a súa viabilidade.
Estes hidrogeles poden aplicarse en máis dun lugar do corpo, como a cavidade peritoneal ou a pel. Una vez administrado, o implante quedará nesa posición e garantirá a retención celular. Por outra banda, o hidrogel protexe ás células nai do sistema inmunitario do hóspede, evitando a entrada de células inmunes e anticorpos. Neste punto é importante determinar que a estrutura polimérica do hidrogel permite a difusión dos factores bioactivos liberados polas células nai. Desta forma, o noso sistema permite manter as células encapsuladas no emprazamento dado e liberar de forma sustentable os factores bioactivos. De feito, nos ensaios preclínicos que realizamos cos ratos, os hidrogeles que encapsulan células nai mantivéronse a longo prazo baixo a pel. De feito, ao recuperar os implantes 45 días despois da súa colocación, analizamos as células e comprobamos que seguen vivos.
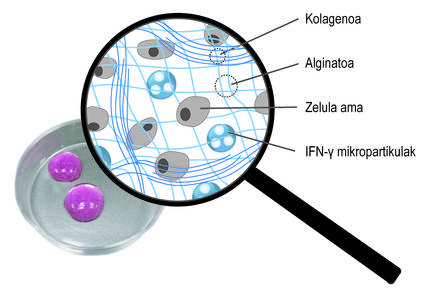
Ademais da encapsulación tridimensional, utilizamos una segunda estratexia paira promover a acción terapéutica das células. En concreto, a idea foi estimular constantemente células nai con mediadores inflamatorios. Paira iso, incluíronse na rede tridimensional da rede de alginato-colágeno hidrogel micropartículas esféricas cargadas co mediador ifn-{ (Figura 4). Os nosos estudos demostraron que este sistema combinado permite manter un microambiente inflamatorio continuo. Así, as células nai producen durante máis tempo factores bioactivos que inhiben o sistema inmunitario. Doutra banda, comprobouse que ao cultivar células nai encapsuladas nestes novos hidrogeles con células do sistema inmunitario, se inhibe o efecto destas últimas. Isto demostra o bo funcionamento do sistema.
En xeral, este novo sistema de doazón que aúna ambas as estratexias, ademais de impulsar e prolongar a acción terapéutica das células, garante a súa retención e viabilidade, o que pode implicar importantes implicacións en terapias baseadas nestas células.
Bibliografía
J. Galipeau and L. Sensebe, Cell. Stem Cell. 2018, 22, 824-833 (DOI:10.1016/j.stem.2018.05.004).
L. J. Scott, BioDrugs, 2018, 32, 627-634 (DOI:10.1007/s40259-018-0311-4).
C. Muroi, K. Miyamura, M. Ocada, T. Yamashita, M. Murata, T. Ishikawa, N. Uike, M. Hidaka, R. Kobayashi, M. Imamura, J. Tanaka, K. Ohashi, S. Taniguchi, T. Ikeda, T. Eto, M. Mori, M. Yamaoka and K. Ozawa, Int. J. Hematol, 2016, 103, 243-250 (DOI:10.1007/s12185-015-1915-9).
A. Gonzalez-Pujana, K. H. Vining, D. C. E. Zhang, E. Santos-Vizcaino, M. Igartua, R. M. Hernandez and D. J. Mooney, Biomaterials, 2020, 257, 120266 (DOI:S0142-9612(20)30512-3).
J. R. Ferreira, G. Q. Teixeira, S. G. Santos, M. A. Barbosa, G. Almeida-Porada and R. M. Goncalves, Front. Inmunol, 2018, 9, 2837 (DOI:10.3389/fimmu.2018.02837).
A. Gonzalez-Pujana, M. Igartua, E. Santos-Vizcaino and R. M. Hernandez, Symphone Opin. Drug Deliv. 2020, 17, 189-200 (DOI:10.1080/17425247.2020.1714587).

Gai honi buruzko eduki gehiago
Elhuyarrek garatutako teknologia



_galeria.jpg)